|
ГДЗ по Химии. 9 класс. Габриелян. Рабочая тетрадь
|
|
| Родион | Дата: Четверг, 01.10.2015, 10:54 | Сообщение # 16 |
|
Подполковник
Группа: Проверенные
Сообщений: 125
Награды: 0
Репутация: 0
Статус: Offline
|
Тема 8. Металлы. Положение металлов в Периодической системе Д. И. Менделеева. Строение атомов и кристаллов. Физические свойства.
Часть I
1. Положение металлов (М) в Периодической системе Д. И. Менделеева.
Условная диагональ от В к At через элементы А групп: IV → V → VI. На диагонали и над ней расположены неметаллы, а под ней – металлы.
Только из М состоят В группы. Всего из 110 элементов к металлам относят 88 элементов.
IA группа – это щелочные металлы.
IIA группа – это щелочноземельные металлы.
2. Особенности строения атомов М:
1) число е во внешнем слое атома 1-3;
2) R атома – большие размеры.
3. Относительность деления элементов на М и НМ (приведите примеры):
1) серое олово – НМ, белое олово – М.
2) графит – НМ, но электропроводный.
3) Cr, Zn, Al – М, но амфотерные.
4. Металлическая химическая связь – это связь в металлах и сплавах между атом-ионами посредством обобществлённых е.
Общая схема образования металлической связи:

5. Заполните таблицу «Строение и свойства металлов».

6. Запишите признаки, по которым можно различить пластины, изготовленные:
а) из алюминия и меди – цвет, плотность, электро- и теплопроводность
б) из свинца и алюминия – цвет, плотность, температура плавления
в) из серебра и графита – цвет, форма, электропроводность.
7. Используя рисунки, заполните пропуски, чтобы получилась последовательность: название металла (ов), свойства (о), область (и) применения.
а) чугунная батарея - чугун, теплопроводность, прочность, износостойкость. В хозяйстве, быту, металлургии.
б) алюминиевая фольга – алюминий, легко раскатывается, пластичность, высокая электро- и теплопроводность, коррозионная стойкость. В пищевой промышленности, производство сплавов.
в) стальные кнопки и скрепки – сталь, «мягкая» сталь, эластична, легко гнется, не ржавеет, прочная и твердая. Во всех отраслях народного хозяйства.
г) металлическая опора – железо (сталь), прочны, твердые, не подвергаются действию среды. Во всех отраслях народного хозяйства.
д) купола – золото, инертное, внешний вид. Используется в строительстве – прокатка, в ювелирном деле.
е) термометр – ртуть (жидкий металл), расширяется при нагревании, в медицинских термометрах. Получение сплавов, для добычи золота. Лампы.
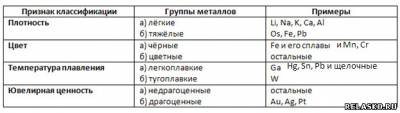
8. Заполните таблицу «Классификация металлов».
9. Сплав – это – это однородный металлический материал, состоящий из смеси двух или большего числа химических элементов с преобладанием металлических компонентов.
10. Чёрные сплавы:
1) чугун, содержание углерода >2%
2) сталь, содержание углерода <2%.
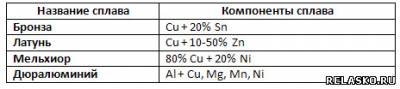
11. Заполните таблицу «Сплавы и их компоненты».
12. Подпишите названия сплавов, из которых могут быть сделаны изображённые на рисунках предметы.
а) сталь
б) мельхиор
в) дюралюминий
г) бронза
д) бронза
е) чугун
|
| |
| |
| Родион | Дата: Четверг, 01.10.2015, 10:55 | Сообщение # 17 |
|
Подполковник
Группа: Проверенные
Сообщений: 125
Награды: 0
Репутация: 0
Статус: Offline
| Часть II
1. Атомы металлов, имеющие во внешнем слое:
а) 5е – Sb (сурьма), Bi (висмут)
б) 6е – Po (полоний)
Почему?
Они расположены в 5 и 6 группах соответственно
2. Атом металла, имеющий во внешнем слое 3е, - бор.
Почему?
Он расположен в 3 группе.
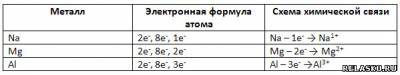
3. Заполните таблицу «Строение атома и химическая связь».
4. Исключите «лишний элемент».
4) Si
5. Какая из следующих групп элементов содержит только металлы?
Нет правильного ответа
6. Какое физическое свойство не является общим для всех металлов?
3) твёрдое агрегатное состояние при стандартных условиях
7. Какое утверждение верно?
4) атомы металлов и металлы – простые вещества проявляют только восстановительные свойства.
8. Все элементы главных подгрупп являются металлами, если они расположены в Периодической системе ниже диагонали:
3) бор – астат
9. Число электронов на внешнем электронном уровне атома металла, находящегося в главной подгруппе Периодической системы, не может быть равно:
4) 7
|
| |
| |
| Родион | Дата: Четверг, 01.10.2015, 16:13 | Сообщение # 18 |
|
Подполковник
Группа: Проверенные
Сообщений: 125
Награды: 0
Репутация: 0
Статус: Offline
| Тема 9. Общие химические свойства металлов.
Часть I
1. Атомы и простые вещества – металлы проявляют только восстановительные свойства. Общая схема этого утверждения:
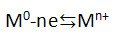
2. М восстанавливают:
1) неметаллы, образуя бинарные соединения;
2) кислород, образуя:
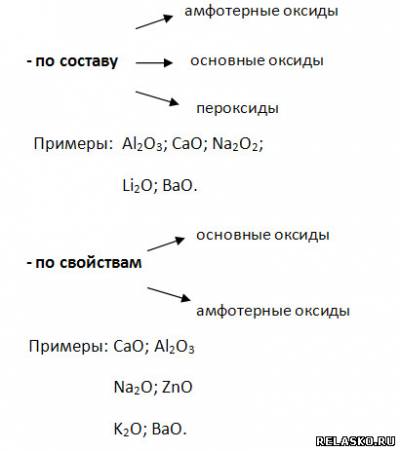
3) катионы водорода из растворов кислот, если:
1) металл находится в ряду напряжений до H2
2) если образуется растворимая соль
3) исключения: щелочные M, концентрированные HNO3 и H2SO4
4) катионы металлов из растворов их солей, если:
- металл соли находится правее самого металла;
- сам вытесняется из раствора соли более сильным металлом.
- если образуется растворимая соль; исключение: щелочные M.
5) водород из воды. В общем виде уравнения для металлов групп IA и IIA (начиная с Ca):
2M+2HOH →2MOH+H2 (для IA)
M+2HOH → M(OH)2+H2 (для IIA)
6) катионы металлов из их оксидов: металлотермия
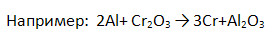
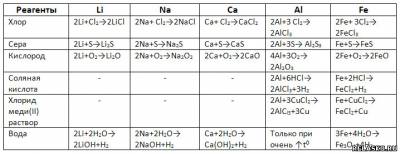
3. Заполните таблицу «Химические свойства металлов», записав уравнения возможных реакций.
4. Подчеркните вещества, с которыми взаимодействует железо:
Хлор, сера, серная кислота (разб.), раствор сульфата меди (II).

|
| |
| |
| Родион | Дата: Четверг, 01.10.2015, 16:15 | Сообщение # 19 |
|
Подполковник
Группа: Проверенные
Сообщений: 125
Награды: 0
Репутация: 0
Статус: Offline
| Часть II
1. Подчеркните вещества, с которыми взаимодействует алюминий:
Углерод, оксид железа (III), серная кислота (разб.).

2. Из перечисленных металлов наиболее активно взаимодействует с водой:
3) калий
3. Образование основного оксида происходит при горении в кислороде:
2) кальция
4. При обычных условиях с водой не взаимодействует:
4) железо
5. Восстановить водород при взаимодействии с раствором серной кислоты способен каждый металл ряда:
3) Fe, Mn, Cr
6. Металлы «Б» и «В» можно получить, вытесняя из водных растворов их солей металлом «А», в группе:
4) «А» - Mg «Б» - Pb «В» - Mn
7. Сокращённым ионным уравнением
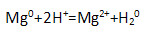
описывается взаимодействие с магнием:
2) соляной кислоты
8. Напишите синквейн о металлах.
1) Металлы
2) Блестящие и серебристые
3) Электро-, теплопроводны, пластичны
4) Используются в промышленности
5) Сплавы
|
| |
| |
| Родион | Дата: Четверг, 01.10.2015, 16:17 | Сообщение # 20 |
|
Подполковник
Группа: Проверенные
Сообщений: 125
Награды: 0
Репутация: 0
Статус: Offline
| Тема 10. Получение металлов.
Часть I
1. Металлы в природе встречаются:
1) только в самородном виде Pt, Ag, Au
2) и в свободном, и в виде соединений Cu, Hg
3) только в виде соединений: большинство, а также активные М (минералы Zn, Pb, Na, Li и др.)
Обобщение этих утверждений оформите с помощью ряда активности металлов, используя фигурные скобки:

2. Минералы – это различные природные соединения, включающие в себя М в связанном состоянии.
Заполните таблицу «Названия и формулы минералов металлов».

3. Руды – это природные образования, содержащие минералы, в которых М находятся в количествах, пригодных для получения их самих.
4. Металлургия – это наука о методах и процессах производства металлов из руд и других металлосодержащих продуктов.
5. Заполните таблицу «Классификация общих способов получения металлов».

|
| |
| |
| Родион | Дата: Четверг, 01.10.2015, 16:20 | Сообщение # 21 |
|
Подполковник
Группа: Проверенные
Сообщений: 125
Награды: 0
Репутация: 0
Статус: Offline
| Часть II
1. Отделение пустой породы от руды – это обогащение.
2. Заполните таблицу «Восстановители в пирометаллургии».
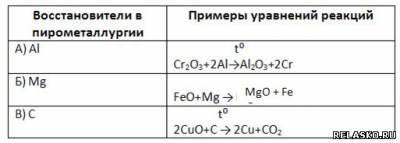
3. Дополните схему:

Это пример электрометаллургии.
4. Сырьём для получения алюминия являются:
а) алюмосиликаты
б) боксит, корунд
в) оксид алюминия.
5. Нарисуйте и опишите схему электролитического получения алюминия.
Процесс получения алюминия электролизом проводят в электролитических ваннах в присутствии расплавленного криолита; из оксида алюминия;

6. Напишите синквейн о металлургии.
1) Металлы
2) Способ получения
3) Пиро-, электро-, гидрометаллургия
4) Основа промышленности
5) Получение.
7. Нарисуйте и опишите схему доменного процесса.
Сущность доменного процесса состоит в восстановлении железа из оксидов и получении науглероженного металла (чугуна) и шлака, которые легко отделяются друг от друга из-за различия в плотностях.
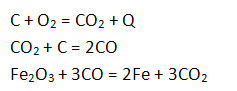
Полученное в результате реакции железо каплями стекает по раскаленному коксу вниз, насыщаясь углеродом, в результате чего получается сплав, содержащий 2,14 – 6,67 % углерода (чугун). Кроме углерода в него входят небольшая доля кремния и марганца. В количестве десятых долей процента в состав чугуна входят также вредные примеси — сера и фосфор. Кроме чугуна в горне образуется и накапливается шлак, в котором собираются все вредные примеси.
|
| |
| |
| Родион | Дата: Четверг, 01.10.2015, 16:51 | Сообщение # 22 |
|
Подполковник
Группа: Проверенные
Сообщений: 125
Награды: 0
Репутация: 0
Статус: Offline
| Тема 11. Коррозия металлов.
Часть I
1. Коррозия – это самопроизвольное разрушение металлов и сплавов под действием окружающей среды.
2. 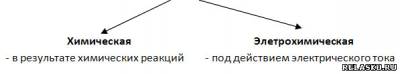
3.Условия протекания электрохимической коррозии:
1) Влага
2) Кислород атмосферный
4. Вред, который наносит коррозия:
а) страдает экология;
б) теряется 25% всего произведенного железа;
в) портятся металлические изделия;
г) страдает здоровье людей.
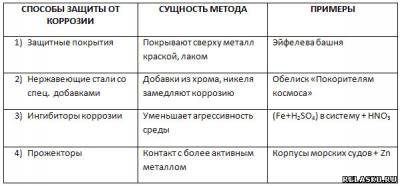
5. Заполните таблицу «Защита металлов от коррозии».
|
| |
| |
| Родион | Дата: Четверг, 01.10.2015, 16:53 | Сообщение # 23 |
|
Подполковник
Группа: Проверенные
Сообщений: 125
Награды: 0
Репутация: 0
Статус: Offline
| Часть II
1. Запишите уравнение реакций, протекающих на воздухе с литием, лишённым вазелиновой защиты.

2. «По крыше выложили жесть» (В. В. Маяковский). Опишите процессы, происходящие с белой жестью при нарушении оловянной защиты.
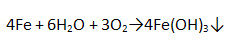
Железо ржавеет.
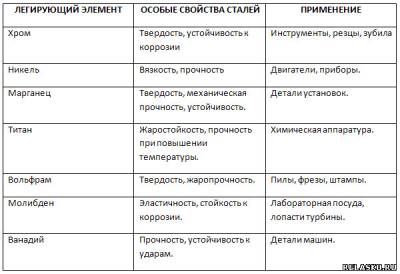
3. Заполните таблицу «Свойства некоторых легированных сталей и их примесей».
4. Опишите, какие способы защиты металлов от коррозии используются у вас в ванной комнате и на кухне.
Эмаль, лаки, краски.
5. Напишите синквейн о коррозии металлов.
а) Коррозия
б) Вредный, портящий
в) Разрушает, мешает, портит
г) Вредный процесс, разлагает
д) Металлы
6. Перечислите наиболее часто используемые способы защиты от коррозии изделий, изображенных на рисунках.
а) Покрытие сплавом мельхиора.
б) Эмаль
в) Легирование стали ванадием.
г) Легирование хромом
д) Лужение оловом
е) Легирование титаном
7. Приведите примеры электрохимических процессов (электрохимической коррозии), приносящих людям пользу.
1) Гальванотехника – нанесение покрытия в виде металлов и сплавов.
2) Электрофорез, электродиализ, электроосмос.
|
| |
| |
| Родион | Дата: Четверг, 01.10.2015, 16:56 | Сообщение # 24 |
|
Подполковник
Группа: Проверенные
Сообщений: 125
Награды: 0
Репутация: 0
Статус: Offline
| Тема 12. Щелочные металлы.
Часть I
1. Заполните таблицу «Изменение свойств щелочных металлов».

2. Схема химической связи: М-1е=М+1
связь металлическая.
3. Общие химические свойства.
Дополните уравнения реакций щелочных металлов с различными соединениями, записав окислительно-восстановительный баланс к ним.

4. Получение – электролиз расплавов хлоридов или гидроксидов.

|
| |
| |
| Родион | Дата: Четверг, 01.10.2015, 16:59 | Сообщение # 25 |
|
Подполковник
Группа: Проверенные
Сообщений: 125
Награды: 0
Репутация: 0
Статус: Offline
| Часть II
1. Дополните цепочку переходов. Запишите уравнения реакцией, с помощью которых можно осуществить превращения по схеме. Рассмотрите их с позиций окисления-восстановления, а последний переход представьте в свете ТЭД.
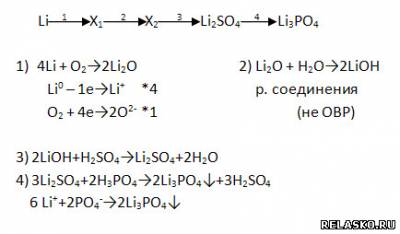
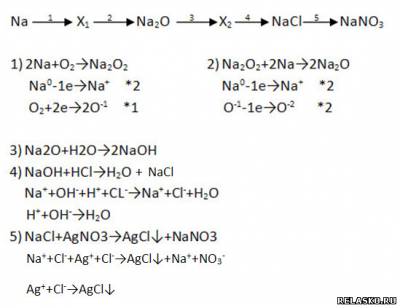
2. Дополните цепочку переходов. Запишите уравнения реакций, с помощью которых можно осуществить превращения по схеме. Рассмотрите переходы как ОВР, а два последних перехода представьте в свете ТЭД.
3. Сравните способы защиты от коррозии Li и Na.
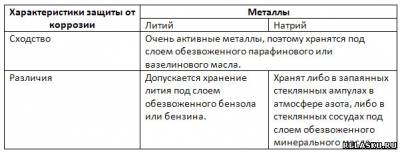
4. Рассчитайте массу натрия и объём хлора, полученных в результате электролиза 585 кг хлорида натрия, содержащего 12% примесей.

5. Какой объём займёт водород, выделившейся при растворении в 0,5 л воды 69 г натрия? Какова массовая доля щёлочи в полученном растворе?

6. С помощью дополнительных источников информации (интернет), подготовьте небольшое сообщение об одном из щелочных металлов. Запишите план этого сообщения или тезисы в особой тетради.
Литий был открыт в 1817 году шведским химиком и минералогом Иоганном Арфведсоном сначала в минерале петалите. Металлический литий впервые получил Гемфри Дэви в 1825 году.
Свое название литий получил из-за того, что был обнаружен в «камнях» (от греч. литий – камень). Основные минералы лития — слюда лепидолит.
Литий — серебристо-белый металл, мягкий и пластичный, тверже натрия, но мягче свинца. Из всех щелочных металлов литий характеризуется самыми высокими температурами плавления и кипения, у него самая низкая плотность при комнатной температуре среди всех металлов.
Литий является наименее активным щелочным металлом, с сухим воздухом при комнатной температуре практически не реагирует. По этой причине литий является единственным щелочным металлом, который не хранят в керосине, он может непродолжительное время храниться на воздухе. Литий и его соли окрашивают пламя в карминово-красный цвет.
Применение:
• Термоэлектрические материалы
• Химические источники тока
• Ракетное топливо
• Лазерные материалы
• Сплавы – в авиации и космонавтике
• Оптический материал в радиоэлектронике, аккумуляторы
• Металлургия – восстановления методами металлотермии редких металлов
• Ядерная энергетика
• В медицине
• В качестве смазочных материалов
• Прочие области применения: соединения лития используются в текстильной промышленности (отбеливание тканей), пищевой (консервирование) и фармацевтической (изготовление косметики).
|
| |
| |
| Родион | Дата: Четверг, 01.10.2015, 17:15 | Сообщение # 26 |
|
Подполковник
Группа: Проверенные
Сообщений: 125
Награды: 0
Репутация: 0
Статус: Offline
| Тема 13. Соединения щелочных металлов.
Часть I
1. Оксиды – M2O.
1) Тип связи – ионная.
Схема ее образования:
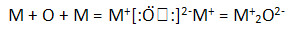
Тип кристаллической решетки: ионная.
2) Характер оксидов – основный.
Химические свойства оксидов:
а) M2 O + кислотный оксид→соль
б) M2 O + H2O → щелочь
в) M2 O + HNO3→ соль MNO3 + H2O
3) Получение:
а) 4LI + O2→2Li2O;
б) Na→X→Na2O.
Запишите уравнения соответствующих реакций.
2Na + O2→Na2O2
Na2O2 + 2Na→2Na2O
2. Гидроксиды МОН.
1) Тип кристаллической решетки – ионный. Состоят из катионов М+ и анионов ОН-. Физические свойства: твердые белые вещества, гигроскопичны.
Растворы – это щелочи.
2) Химические свойства (составьте уравнения возможных реакций – молекулярные, полные и сокращенные ионные):
а) пример реакции нейтрализации:
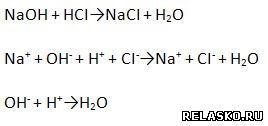
б) Взаимодействуют с кислотными оксидами.

в) Взаимодействуют с солями, если образуется осадок:
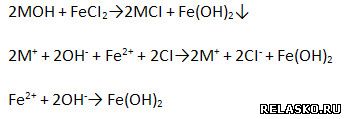
г) взаимодействует с солями, если образуется газ:
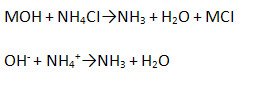
д) Взаимодействуют с амфотерными оксидами:
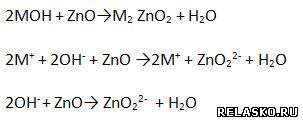
е) Взаимодействует с амфотерными гидроксидами.
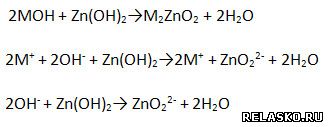
3) Получение:
a) 2M + 2HOH→2MOH + H2
б) M2O + HOH→2MOH
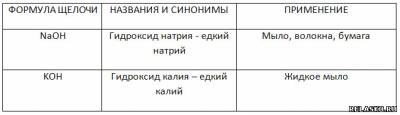
4) Заполните таблицу «Щелочи и их применение».
3. Соли имеют ионную кристаллическую решетку.
Заполните таблицу «Названия и применение солей металлов IA группы».
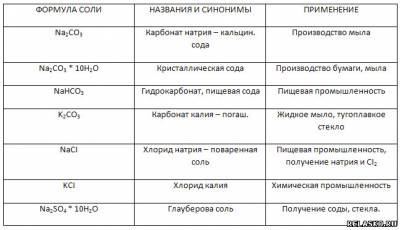
4. Заполните таблицу «Окрашивание пламени ионами щелочных металлов».
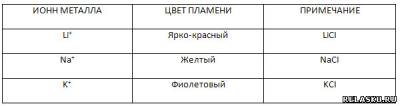
|
| |
| |
| Родион | Дата: Четверг, 01.10.2015, 17:17 | Сообщение # 27 |
|
Подполковник
Группа: Проверенные
Сообщений: 125
Награды: 0
Репутация: 0
Статус: Offline
| Часть II
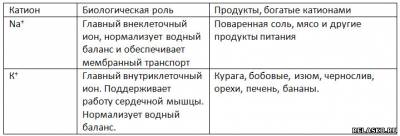
1. Заполните таблицу «Биологическая роль катионов натрия и калия».
2. Дополните цепочку переходов. Запишите уравнения реакций, с помощью которых можно осуществить превращения по схеме:

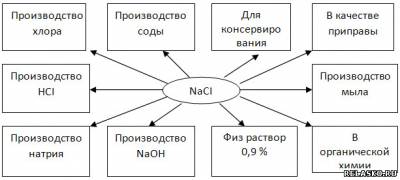
3. Заполните схему «Области применения хлорида натрия».
4. Для соединения NaH укажите:
1) Название гидрид натрия
2) Тип связи и кристаллическую решетку - ионная связь, ионная кристаллическая решетка
3) Схему образования связи на основе реакции получения (синтеза) 2Na + H2→ 2NaН.
4) Уравнение реакции взаимодействия с водой (рассмотрите ОВР)

5. Пероксид натрия Na2O2 имеет структурную формулу:
Na – O – O – Na.
Укажите тип связи между атомами:
а) натрия и кислорода ионная
б) кислорода и кислорода ковалентная неполярная
Наличие разных типов связи в одном соединении говорит о единой природе химической связи.
6. По образцу сочинения, приведённого в заданиях учебного параграфа, напишите сочинение на тему «Художественный образ соединения щелочного металла» в особой тетради.
|
| |
| |
| Родион | Дата: Четверг, 01.10.2015, 17:25 | Сообщение # 28 |
|
Подполковник
Группа: Проверенные
Сообщений: 125
Награды: 0
Репутация: 0
Статус: Offline
| Тема 14. Бериллий, магний и щёлочноземельные металлы.
Часть I
1. Заполните таблицу «Изменение свойств щёлочноземельных металлов».

2. Схема химической связи для металлов IIA группы (М):
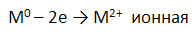
3. Общие химические свойства (для щёлочноземельных металлов - М).
Рассмотрим ОВР.
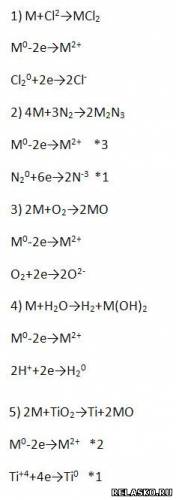
4. BeO и Be(OH)2 относят к амфотерным соединениям. Запишите уравнения реакций, подтверждающих это, в молекулярной, полной и сокращённой ионной формах.
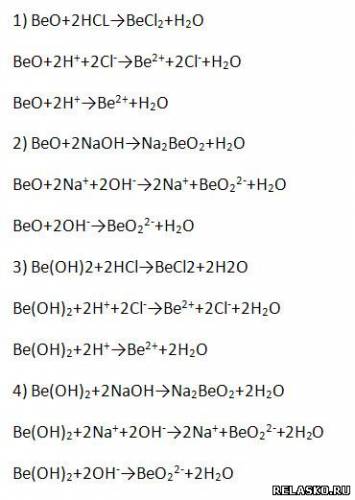
5. Подобно щелочным, щёлочноземельные металлы образуют гидриды с общей формулой МН2:
- это соединение с ионной кристаллической решёткой;
- образованы за счёт ионной химической связи, схема которой: 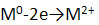
- по физическим свойствам эти вещества твёрдые, белые, растворимые в воде.
- взаимодействуют с водой (рассмотрите ОВР).

|
| |
| |
| Родион | Дата: Четверг, 01.10.2015, 17:33 | Сообщение # 29 |
|
Подполковник
Группа: Проверенные
Сообщений: 125
Награды: 0
Репутация: 0
Статус: Offline
| Часть II
1. Заполните таблицу «Применение кальция и магния».

2. Дополните цепочку переходов. Составьте уравнения реакций, с помощью которых можно осуществить превращения по схеме:

Первую и пятую реакции рассмотрите с позиций окисления-восстановления, остальные – в свете ТЭД. Для перехода Ca→Ca(NO3)2 предложите два варианта.

3. Проанализируйте рисунок «Взаимодействие щёлочноземельных металлов с водой». Подпишите химические формулы металлов. Объясните причину различной скорости реакций.
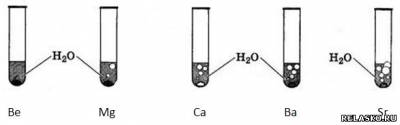
Скорость реакции увеличивается с активностью металла.
4. Укажите, в какой из пробирок отображено взаимодействие лития с водой, а в какой – кальция с водой.
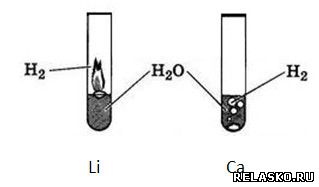
Ответ поясните: Литий легче воды, всплывает и окисляется на поверхности.
5. Какой объём водорода образуется при взаимодействии с 0,5 л воды 20 г кальция, содержащего 5% примесей? Рассчитайте массовую долю щёлочи в полученном растворе.

6. Придумайте и решите задачу, аналогичную предыдущей, чтобы в условии фигурировал гидрид кальция.
Гидрид кальция массой 42 г вступил в реакцию с водой, массой 200 г. Найти w%(Ca(OH)2) и V(H2), если w%(прим. в Ca H2)=10%.
7. Подготовьте небольшое сообщение об одном из щёлочноземельных металлов, используя Интернет и другие источники информации.
Составьте план или запишите тезисы сообщения в особой тетради.
Бериллий.
Открыт в 1798 г. французским химиком Луи Никола Вокленом, который назвал его глицинием. Современное название элемент получил по предложению химиков немца Клапрота и шведа Экеберга. В свободном виде бериллий был выделен в 1828 году французским химиком Бюсси и независимо от него немецким химиком Велером.
Известно более 30 собственно бериллиевых минералов, но промышленное значение имеет в основном берилл.
Разновидности берилла считаются драгоценными камнями: аквамарин, изумруд, гелиодор. Известны другие разновидности берилла, различающиеся окраской (темно-синие, розовые, красные, бледно-голубые, зеленые, бесцветные и др.). Цвет бериллу придают примеси.
Бериллий — относительно твердый, но хрупкий металл серебристо-белого цвета. Один из самых твердых металлов в чистом виде (уступает только осмию, вольфраму и урану). На воздухе покрывается стойкой оксидной пленкой. В бериллии очень хорошо распространяются звуковые волны — 12600 м/с.
Применяется в различных отраслях промышленности и народного хозяйства:
• Рентгенотехника
• Ядерная энергетика
• Лазерные материалы
• Аэрокосмическая техника
• Ракетное топливо
• Огнеупорные материалы
Бериллий ядовит: летучие (и растворимые) соединения бериллия, в том числе и пыль, содержащая соединения бериллия, высокотоксичные. Бериллий обладает ярко выраженным аллергическим и канцерогенным действием. Вдыхание атмосферного воздуха, содержащего бериллий, приводит к тяжелому заболеванию органов дыхания — бериллиозу.
|
| |
| |
| Родион | Дата: Четверг, 01.10.2015, 17:47 | Сообщение # 30 |
|
Подполковник
Группа: Проверенные
Сообщений: 125
Награды: 0
Репутация: 0
Статус: Offline
| Тема 15. Соединения щёлочноземельных металлов.
Часть I
1. Оксиды – МО.
1) Имеют ионную кристаллическую решётку и образованы за счёт ионной химической связи, схема которой:
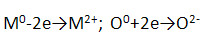
Физические свойства данных соединений: белые гигроскопичные кристаллические вещества.
2) Характер оксидов – основный, что подтверждается химическими свойствами (напишите уравнения возможных реакций – молекулярные, полные и сокращённые ионные):

2. Гидроксиды M(OH)2.
1) Тип кристаллической решётки – ионная, состоит из катионов М2+ и анионов ОН-.
Физические свойства: белые кристаллические вещества, хорошо растворяются в воде.
Растворы – это щёлочи.

Реакция с участием оксида кальция:
CaO+H2O=Ca(OH)2
называется гашение извести.
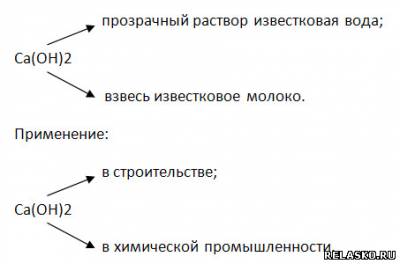
2) Химические свойства (составьте уравнения возможных реакций в молекулярной, полной и сокращённой ионной формах):
а) реакция нейтрализации:
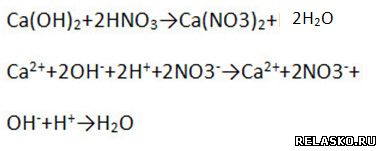
б) взаимодействует с нерастворимой кислотой (составьте уравнения возможных реакций в молекулярной, полной и сокращённой ионной формах)
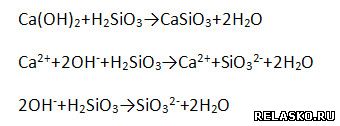
в) взаимодействует с кислотными оксидами
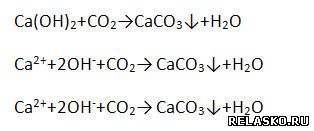
г) взаимодействует с солями, если образуется ↑
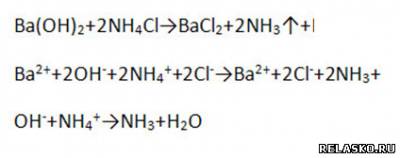
д) взаимодействует с солями, если образуется ↓
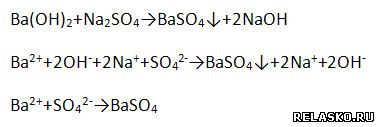
е) взаимодействует с амфотерными оксидами
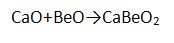
ж) взаимодействует с амфотерными основаниями
Читать продолжение решебника...
|
| |
| |