|
ГДЗ по Химии. 9 класс. Габриелян. Рабочая тетрадь
|
|
| Родион | Дата: Четверг, 01.10.2015, 17:50 | Сообщение # 31 |
|
Подполковник
Группа: Проверенные
Сообщений: 125
Награды: 0
Репутация: 0
Статус: Offline
|
Часть II
1. Как различить кристаллические сульфаты магния, кальция, бария?
При растворении в воде:
MgSO4 – растворится полностью;
CaSO4 – растворится частично;
BaSO4 – не растворится.
2. Запишите уравнения реакций, с помощью которых можно осуществить превращения по схеме:
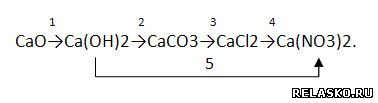
Для всех реакций, кроме первой, запишите уравнения в молекулярной, полной и сокращённой ионной формах:
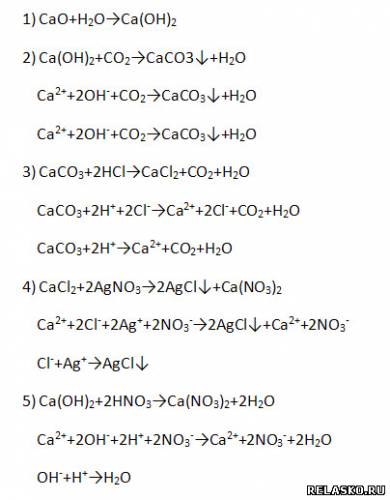
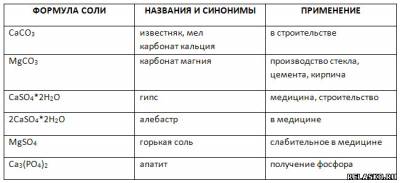
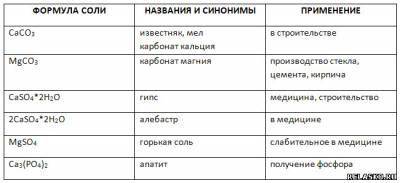
3. Заполните таблицу «Применение солей кальция и магния»
4. Фосфоры – это люминофоры
Область их применения: Шоу-техника, декорации, светящиеся диски.
5. Напишите синквейн о химическом элементе кальции или его соединении.
1. кальций
2. металлический и блестящий
3. химически активный
4. основа минералов
5. строительство.
6. Какую массу известняка, содержащего 20% примесей, подвергли обжигу, если получено 112 кг негашёной извести?

|
| |
| |
| Родион | Дата: Четверг, 01.10.2015, 17:56 | Сообщение # 32 |
|
Подполковник
Группа: Проверенные
Сообщений: 125
Награды: 0
Репутация: 0
Статус: Offline
| Тема 15. Соединения щёлочноземельных металлов.
Часть I
1. Оксиды – МО.
1) Имеют ионную кристаллическую решётку и образованы за счёт ионной химической связи, схема которой:
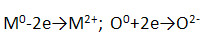
Физические свойства данных соединений: белые гигроскопичные кристаллические вещества.
2) Характер оксидов – основный, что подтверждается химическими свойствами (напишите уравнения возможных реакций – молекулярные, полные и сокращённые ионные):

2. Гидроксиды M(OH)2.
1) Тип кристаллической решётки – ионная, состоит из катионов М2+ и анионов ОН-.
Физические свойства: белые кристаллические вещества, хорошо растворяются в воде.
Растворы – это щёлочи.

Реакция с участием оксида кальция:
CaO+H2O=Ca(OH)2
называется гашение извести.
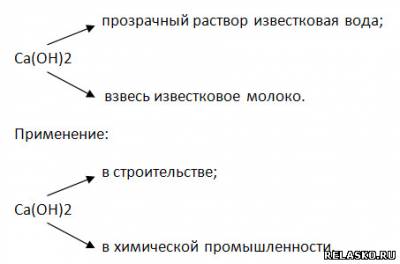
2) Химические свойства (составьте уравнения возможных реакций в молекулярной, полной и сокращённой ионной формах):
а) реакция нейтрализации:
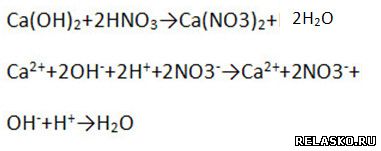
б) взаимодействует с нерастворимой кислотой (составьте уравнения возможных реакций в молекулярной, полной и сокращённой ионной формах)
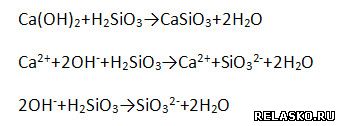
в) взаимодействует с кислотными оксидами
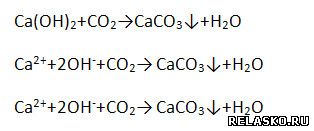
г) взаимодействует с солями, если образуется ↑
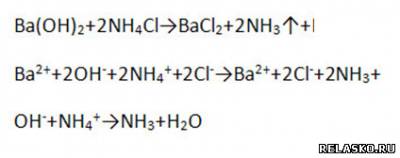
д) взаимодействует с солями, если образуется ↓
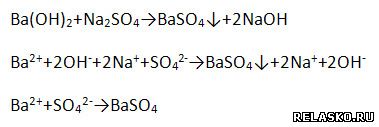
е) взаимодействует с амфотерными оксидами
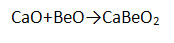
ж) взаимодействует с амфотерными основаниями
|
| |
| |
| Родион | Дата: Четверг, 01.10.2015, 17:59 | Сообщение # 33 |
|
Подполковник
Группа: Проверенные
Сообщений: 125
Награды: 0
Репутация: 0
Статус: Offline
| Часть II
1. Как различить кристаллические сульфаты магния, кальция, бария?
При растворении в воде:
MgSO4 – растворится полностью;
CaSO4 – растворится частично;
BaSO4 – не растворится.
2. Запишите уравнения реакций, с помощью которых можно осуществить превращения по схеме:
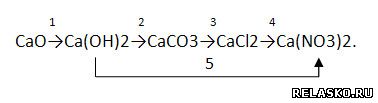
Для всех реакций, кроме первой, запишите уравнения в молекулярной, полной и сокращённой ионной формах:
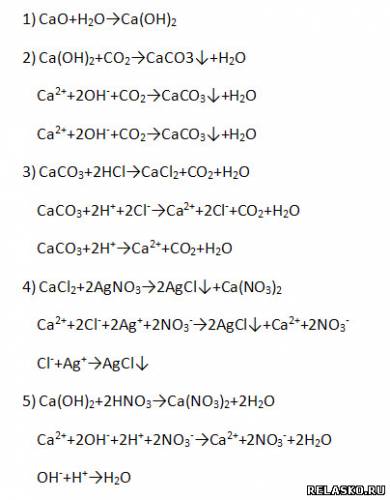
3. Заполните таблицу «Применение солей кальция и магния»
4. Фосфоры – это люминофоры
Область их применения: Шоу-техника, декорации, светящиеся диски.
5. Напишите синквейн о химическом элементе кальции или его соединении.
1. кальций
2. металлический и блестящий
3. химически активный
4. основа минералов
5. строительство.
6. Какую массу известняка, содержащего 20% примесей, подвергли обжигу, если получено 112 кг негашёной извести?

|
| |
| |
| Родион | Дата: Пятница, 02.10.2015, 09:24 | Сообщение # 34 |
|
Подполковник
Группа: Проверенные
Сообщений: 125
Награды: 0
Репутация: 0
Статус: Offline
| Тема 16. Алюминий.
Часть I
1. Дополните схему строения атома алюминия.
13Al 2е, 8е, 3е или 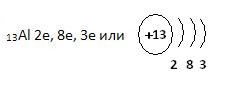
2. Al проявляет сильные восстановительные свойства, получая при этом с.о. +3, по соответствующей схеме:
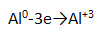
3. Эта же схема отражает образование в простом веществе металлической связи.
Алюминий имеет металлическую кристаллическую решётку и характеризуется следующими физическими свойствами: серебристо-белый, электро-, термопроводен, пластичный.
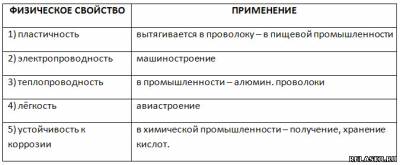
4. Заполните таблицу «Применение алюминия на основе его физических свойств».
5. В ряду активности металлов алюминий следует за металлами IIA группы, т.е. очень активен, но с водой, как подсказывает бытовой опыт, не взаимодействует при обычных условиях (алюминиевые провода и посуда не разрушаются под действием воды). Почему?
Есть защитная плёнка оксида алюминия.
Как осуществить реакцию, схема которой:
Al+H2O→Al(OH)3+H2 ?
Растереть алюминий в порошок и смешать с водой при высокой температуре.
6. Химические свойства алюминия (запишите уравнения возможных реакций – молекулярные, полные и сокращённые ионные).
1) Сгорает при нагревании (рассмотрите с позиций окисления-восстановления).

2) Взаимодействует с неметаллами (рассмотрите ОВР).
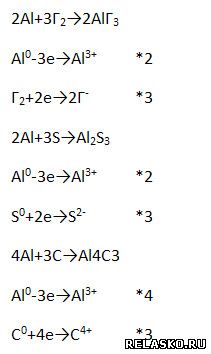
3) Взаимодействует с растворами кислот.
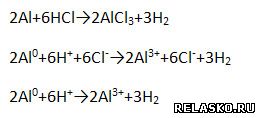
4) Взаимодействует с растворами солей.
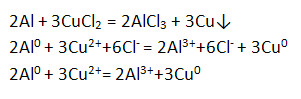
5) Взаимодействует с оксидами металлов – алюминотермия.
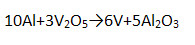
6) Взаимодействует с растворами щелочей.
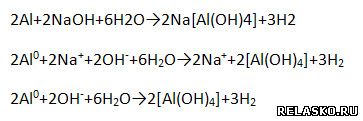
|
| |
| |
| Родион | Дата: Пятница, 02.10.2015, 09:26 | Сообщение # 35 |
|
Подполковник
Группа: Проверенные
Сообщений: 125
Награды: 0
Репутация: 0
Статус: Offline
| Часть II
1. Заполните таблицу «Применение алюминия на основе его химических свойств».
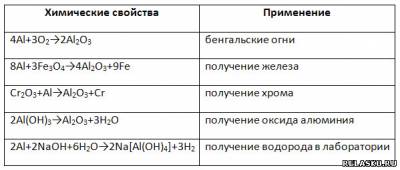
2. Запишите уравнения реакций, с помощью которых можно осуществить соответствующие переходы, в свете ОВР.
3. Амальгама – это соединение, в состав которого входит ртуть.
В химии алюминия она играет важную роль - как восстанавливающий агент в органических синтезах.
4. Подготовьте сообщение об амальгамах золота и их значении, используя различные источники информации(интернет). Запишите тезисы сообщения или составьте его план в особой тетради.
Метод амальгамации основан на способности ртути образовывать сплавы — амальгамы с различными металлами, в том числе и с золотом. В этом методе увлажненная дробленая порода смешивалась со ртутью и подвергалась дополнительному измельчению в мельницах-чашах. Амальгаму золота (и сопутствующих металлов) извлекали промывкой, после чего ртуть отгонялась из собранной амальгамы и использовалась повторно. Метод амальгамации известен с I века до н. э., наибольшие масштабы приобрел в американских колониях Испании начиная с XVI века. Это стало возможным благодаря наличию в Испании огромного ртутного месторождения — Альмаден. В более позднее время использовался метод внешней амальгамации, когда дробленая золотоносная порода при промывке пропускалась через обогатительные шлюзы, выстланные медными листами, покрытыми тонким слоем ртути. Метод амальгамации применим только на месторождениях с высоким содержанием золота или уже при его обогащении. Сейчас он используется очень редко, главным образом старателями в Африке и Южной Америке.
5. Подготовьте с помощью Интернета презентацию (5-10 слайдов) на тему «История алюминия». Запишите план презентации.
1) Открытие алюминия
2) Нахождение в природе
3) Физические и химические свойства
4) Получение
5) Применение
6. Вычислите, какое количество граммов оксида хрома (III), содержащего 20% примесей, и моль алюминия необходимо для получения 4,5 моль хрома с помощью алюминотермии.

|
| |
| |
| Родион | Дата: Пятница, 02.10.2015, 09:28 | Сообщение # 36 |
|
Подполковник
Группа: Проверенные
Сообщений: 125
Награды: 0
Репутация: 0
Статус: Offline
| Тема 17. Соединения алюминия.
Часть I
1. В земной коре алюминий занимает 3 место по содержанию среди всех элементов и 1 – среди металлов.
Массовая доля его в земной коре составляет 9%.
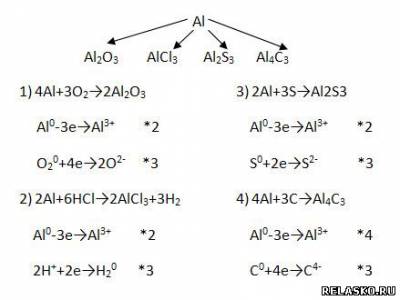
2. Заполните таблицу «Природные соединения алюминия».
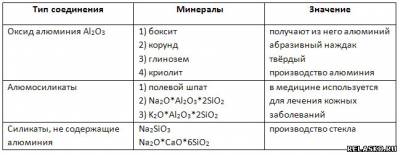
3. Оксид алюминия Al2O3 имеет атомную кристаллическую решётку и построен за счёт ионной химической связи.
Поэтому характеризуется следующими физическими свойствами: белое вещество с очень высокой температурой плавления.
Получение:
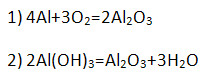
Имеет амфотерный характер, поэтому взаимодействует и с кислотами, и с щелочами (напишите уравнение возможных реакций в молекулярной, полной и сокращённой ионной формах).
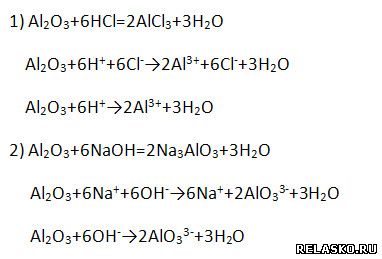
4. Гидроксид алюминия Al(OH)3 является амфотерным соединением и проявляет как основные, так и кислотные свойства (напишите уравнение возможных реакций в молекулярной, полной и сокращённой ионной формах).
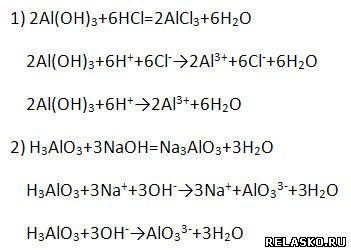
Получают при взаимодействии солей алюминия (изб.) с щелочами, например:

|
| |
| |
| Родион | Дата: Пятница, 02.10.2015, 09:32 | Сообщение # 37 |
|
Подполковник
Группа: Проверенные
Сообщений: 125
Награды: 0
Репутация: 0
Статус: Offline
| Часть II
1. Запишите два молекулярных уравнения реакций, соответствующих сокращённому ионному уравнению:
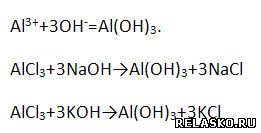
2. Запишите два молекулярных уравнения реакций, соответствующих сокращённому ионному уравнению:
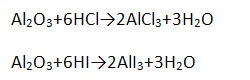
3. Запишите два молекулярных уравнения реакций, соответствующих сокращённому ионному уравнению:
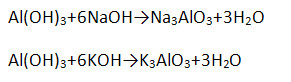
4. Дополните цепочку переходов. Составьте уравнения реакций, с помощью которых можно осуществить превращения по схеме:

Первую реакцию рассмотрите с позиций окисления-восстановления, остальные – в свете ТЭД.

5. Составьте кроссворд (около 10 слов) в особой тетради на тему «Соединения алюминия в ювелирном деле», используя Интернет.
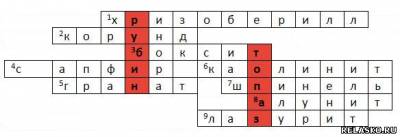
Составив кроссворд, вы получите в выделенных ячейках названия 2-х драгоценных камней, в составе которых есть алюминий.
1. Минерал, алюминат бериллия; зеленовато-желтый, реже бесцветный, красивый и долговечный в огранке.
2. Оксид алюминия, очень богатый алюминием минерал.
3. Основное сырье для получения алюминия; глиноподобная, часто каменистая порода, в качестве примесей в которой обычно присутствуют оксиды кремния, титана, железа и ряд других соединений.
4. Синий драгоценный камень; одна из разновидностей минерала корунда.
5. Ценный минерал, цветом и формой он часто напоминает ягоды крыжовника.
6. Водный алюмосиликат, являющейся основной составной частью каолинов и глин.
7. Ценный камень, желтого, оранжевого, красного, фиолетового, синего, голубого, зеленого или черного цвета массой не более 10 карат.
8. Продукт воздействия на алюмосиликаты природных кислых вод, представляет собой алюминиевые квасцы.
9. Камень с вкраплениями золотистого пирита, напоминающий звездное небо; благодаря своему необычному цвету и возможности полировки до зеркального блеска, он широко применяется в наши дни (краска, фрески, бусы, вазочки, украшения и др.).
6. Напишите сочинение «Художественный образ вещества или процесса» по химии алюминия.
|
| |
| |
| Родион | Дата: Пятница, 02.10.2015, 09:43 | Сообщение # 38 |
|
Подполковник
Группа: Проверенные
Сообщений: 125
Награды: 0
Репутация: 0
Статус: Offline
| Тема 18. Железо.
Часть I
1. Дополните схему строения атома железа.
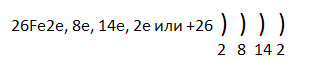
2. Железо проявляет восстановительные свойства, получая при этом
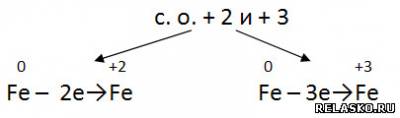
Оно имеет металлическую кристаллическую решетку и характеризуется следующими физическими свойствами: серебристо-белый блестящий металл, температура плавления равна 1539 градусов⁰С, пластичный.
3. Заполните таблицу «Применение железа на основе его физических свойств».
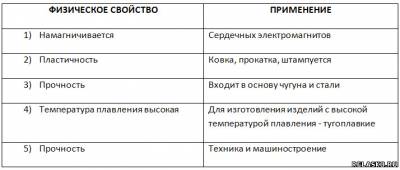
4.
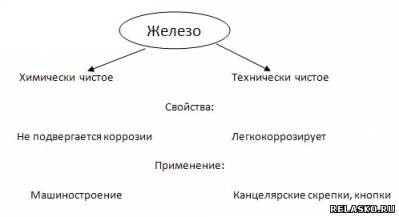
5. Химические свойства железа (рассмотрите с позиций окисления-восстановления).

6. Установите соответствие между соединением и степенью окисления железа в нем.

|
| |
| |
| Родион | Дата: Пятница, 02.10.2015, 09:53 | Сообщение # 39 |
|
Подполковник
Группа: Проверенные
Сообщений: 125
Награды: 0
Репутация: 0
Статус: Offline
| Часть II
1. Запишите уравнения реакций, описывающих получение оксида железа (II) и оксида железа (III) двумя способами, и рассмотрите ОВР.

2. Запишите уравнения реакций обмена, с помощью которых можно получить хлорид железа (II) двумя способами, и рассмотрите их в свете ТЭД.

3. Железо подвергается химической коррозии. Запишите уравнение реакций превращения железа в гидроксид железа (III) и рассмотрите ОВР.
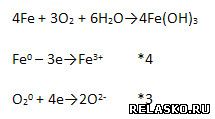
4. Железо контактирует с цинком в присутствии электропроводной среды. Что наблюдается?
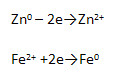
5. Запишите уравнение реакции восстановления оксида железа (III) оксидом углерода (II) и рассмотрите в свете ОВР.

6. Придумайте и решите задачу, используя уравнение из задания 5, на нахождение массы железа по заданной массе оксида, содержащего массовую долю примесей.
Найти массу железа, полученного из 200 г Fe2O3, содержащего 10% примесей.
6. Придумайте и решите задачу, используя уравнение из задания 5, на нахождение массы железа по заданной массе оксида, содержащего массовую долю примесей.
Найти массу железа, полученного из 200 г Fe2O3, содержащего 10% примесей.
4. Напишите синквейн о железе.
1) Железо.
2) Металлическое и блестящие
3) Намагничивается, электропроводно и теплопроводно
4) Применяется в промышленности
5) Сталь
|
| |
| |
| Родион | Дата: Пятница, 02.10.2015, 09:58 | Сообщение # 40 |
|
Подполковник
Группа: Проверенные
Сообщений: 125
Награды: 0
Репутация: 0
Статус: Offline
| Тема 19. Соединения железа.
Часть I
1. Заполните таблицу «Железные руды».

2. Составьте уравнения реакций, с помощью которых можно осуществить превращения по схеме:

3. Запишите уравнения реакций для переходов:

4. Запишите уравнение реакции получения Fe(OH)3 из Fe(OH)2.
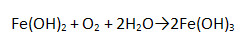
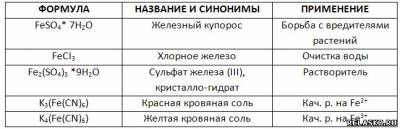
5. Заполните таблицу «Применение солей железа».
|
| |
| |
| Родион | Дата: Пятница, 02.10.2015, 10:01 | Сообщение # 41 |
|
Подполковник
Группа: Проверенные
Сообщений: 125
Награды: 0
Репутация: 0
Статус: Offline
| Часть II
1. Запишите два молекулярных уравнения реакций, соответствующих сокращенному ионному уравнению:
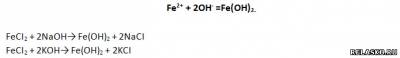
2. Запишите два молекулярных уравнения реакций, соответствующих сокращенному ионному уравнению:
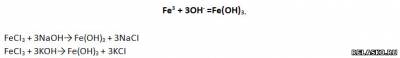
3. Запишите два уравнения реакций замещения для получения хлорида железа (II). Рассмотрите их в свете ОВР.
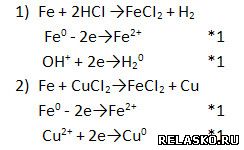
4. Запишите уравнения реакции обмена и реакции соединения для получения хлорида железа (III). Рассмотрите их в свете ОВР или ТЭД соответственно.
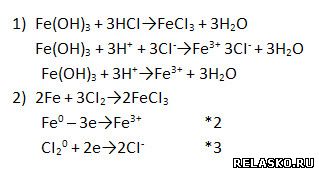
5. Укажите продукты питания для человека, страдающего малокровием.

6. Запишите не менее четырех уравнений реакций с различными катионами и анионами, соответствующих сокращенному ионному:

7. Запишите молекулярные и ионные уравнения реакций, подтверждающих качественный состав хлорида железа (III).
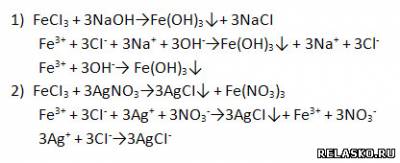
|
| |
| |
| Родион | Дата: Пятница, 02.10.2015, 10:11 | Сообщение # 42 |
|
Подполковник
Группа: Проверенные
Сообщений: 125
Награды: 0
Репутация: 0
Статус: Offline
| Тема 20. Общая характеристика неметаллов.
Часть I
1. Положение неметаллов (НМ) в Периодической системе.
По диагонали B-At и над ней в 6 группах располагаются неметаллы. Всего из 114 элементов к НМ относят 22.
2. Особенности строения атомов НМ:
1) небольшой радиус атома
2) число электронов на внешнем уровне 4-8.
3. НМ обладают свойством аллотропии – явление существования одного хим. элемента в виде 2 или нескольких простых веществ.
4. Заполните таблицу «Причины аллотропии».

5. НМ – простые вещества и свободные атомы, проявляют и окислительные, и восстановительные свойства.
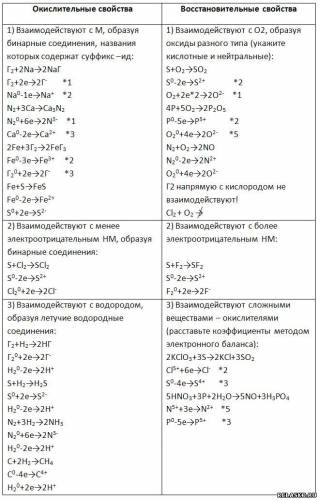
Заполните таблицу «Химические свойства неметаллов».
Запишите уравнения реакций, рассмотрите их в свете процессов окисления-восстановления.
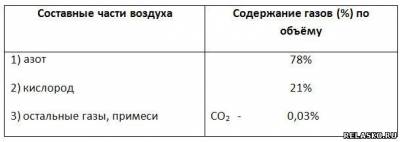
6. Дополните таблицу «Состав воздуха».
|
| |
| |
| Родион | Дата: Пятница, 02.10.2015, 10:14 | Сообщение # 43 |
|
Подполковник
Группа: Проверенные
Сообщений: 125
Награды: 0
Репутация: 0
Статус: Offline
| Часть II
1. Запишите, в каком порядке «выкипают» из жидкого воздуха его основные составные части.
1) азот N2 (tк)=-196 ⁰С
2) аргон Ar (tк)=-186 ⁰С
3) кислород O2 (tк)=-183 ⁰С
2. Молярный объём воздуха имеет массу 29 г. Величина, показывающая, во сколько раз молярная масса любого газа тяжелее М воздуха, называется относительной плотностью этого газа по воздуху и обозначается Dвозд.
Найдите Dвозд для:

3. Какой объём каждого из трёх основных компонентов воздуха можно получить из 500 м3 воздуха?

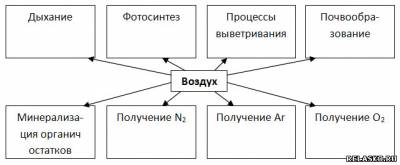
4. Дополните схему «Роль воздуха в природе и жизни человека».
5. Соотнесите газ, собираемый способом вытеснения воздуха, с расположением сосуда.
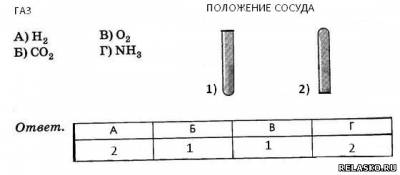
6. Выберите явления, которые вызывает присутствие в воздухе его составных частей: 1) случайных; 2) переменных. Из букв, соответствующих правильным ответам, вы составите названия химических элементов – неметаллов:
1) азот; 2) сера.
а) смог – 1
б) парниковый эффект – 2
в) грипп – 1
г) озоновые дыры – 2
д) аллергия на цветение растений – 1
е) туман – 2
ж) кислотные дожди – 1
з) свежесть воздуха в сосновых лесах – 2
|
| |
| |
| Родион | Дата: Пятница, 02.10.2015, 10:18 | Сообщение # 44 |
|
Подполковник
Группа: Проверенные
Сообщений: 125
Награды: 0
Репутация: 0
Статус: Offline
| Тема 21. Водород.
Часть I
1. Строение атома: 1Н 1е
2. Строение молекулы. Молекула Н2 образована за счёт ковалентной неполярной химической связи.
Молекулярная формула - Н2.
Электронная формула – 1е
Структурная формула – Н-Н
3. Физические свойства водорода: бесцветный газ, без запаха, легче воздуха.
4. Заполните таблицу «Двойственное положение водорода в Периодической системе».
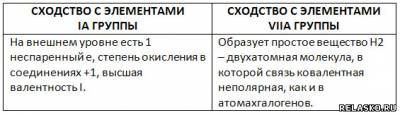
5. Химические свойства водорода (рассмотреть с позиций окисления-восстановления).

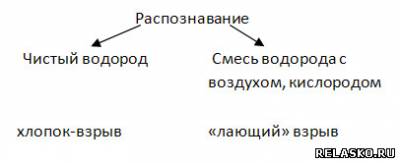
6. Получение, собирание и распознавание водорода.
1) Напишите уравнение реакции, соответствующее лабораторному способу получения водорода, и рассмотрите с позиций окисления-восстановления.

2) Эта реакция протекает в аппарате киппа или приборе Кирюшкина. Укажите верный способ собирания водорода (Б), ответ поясните.
Н2 легче воздуха, поэтому будет собираться в верхней части пробирки.
3) 
7. Дополните схему «Применение водорода».
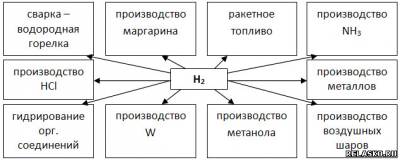
|
| |
| |
| Родион | Дата: Пятница, 02.10.2015, 10:21 | Сообщение # 45 |
|
Подполковник
Группа: Проверенные
Сообщений: 125
Награды: 0
Репутация: 0
Статус: Offline
| Часть II
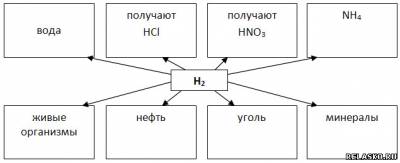
1. На Земле в чистом виде водород не встречается, а в космосе самый распространённый.
Заполните схему «Водород и его соединения в природе».
2. Установите соответствие между продуктами реакции и исходными веществами.

3. Запишите уравнения реакций возможных способов получения водорода в лаборатории и рассмотрите с позиций окисления-восстановления.

4. Закончите уравнение реакции и рассмотрите её с позиций окисления-восстановления.
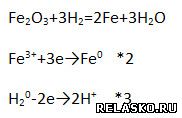
К какому типу металлургии можно отнести данный процесс?
- пирометаллургия
5. Какой объём воздуха нужен для сжигания 120 м3 водорода?

6. На основании решения задания 5 сформулируйте правило Гей-Люссака: объёмы газообразных веществ, участвующих в реакции, соотносятся между собой как небольшие целые числа.
7. Вспомните и запишите определение.
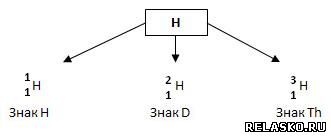
Изотопы – это разновидности химического элемента с одинаковым зарядом ядра и разным массовым числом.
8. Укажите три вида изотопов водорода.
9. Используя Интернет и другие источники информации подготовьте презентацию на тему «Применение тяжёлых изотопов водорода». Запишите план презентации в особой тетради.
Читать продолжение решебника...
|
| |
| |