|
ГДЗ по Химии. 9 класс. Габриелян. Рабочая тетрадь
|
|
| Родион | Дата: Пятница, 02.10.2015, 10:31 | Сообщение # 46 |
|
Подполковник
Группа: Проверенные
Сообщений: 125
Награды: 0
Репутация: 0
Статус: Offline
|
Тема 22. Галогены.
Часть I
1. Строение атомов.
Схема строения внешнего электронного слоя: 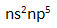
R атома ↑ от F к I.
Восстановительные свойства ↑ от F к I.
Степень окисления F в соединениях -1, у остальных -1, а также +3, +5, +7, +1.
2. Строение молекулы.
Молекула Г2 образована за счёт ковалентной неполярной химической связи.
Молекулярная формула – Г2.
Электронная формула -
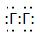
Структурная формула - Г-Г
3. Все галогены – простые вещества имеют молекулярную кристаллическую решётку. от F2 к Cl2 (поставьте знак ↑ или ↓):
- интенсивность цвета ↑;
- плотность ↑;
- металлические свойства ↑;
- неметаллические свойства ↓.
Агрегатное состояние:
F2 – газ;
Cl2 – газ;
Br2 – жидкость;
I2 – твёрдое вещество.
4. Химические свойства.
Наиболее характерны окислительные свойства, которые галогены проявляют по отношению:
1) к металлам (рассмотреть в свете ОВР):
а) Г2+2Na→2NaГ
Г2 – окислитель, Nа – восстановитель.
б) Г2+Са→СаГ2
Г2 – окислитель, Са - восстановитель
в) 3Г2+2Fe→2FeГ3
Г2 – окислитель, Fe – восстановитель.
2) к водороду

Vp↓ уменьшается, т.к. в ряду F2, Cl2, Br2, I2 – окислительные способности уменьшаются.
Потому что: в ряду HF, HCl, HBr, HI – прочность связи уменьшается.
3) к растворам солей, содержащим менее активные галогены (рассмотреть в свете ОВР):

5. Соединения в природе.
В свободном виде в виде двухатомных молекул, или в виде солей из-за высокой активности.
Это галогениды металлов IA и IIA групп (приведите примеры) запишите формулы основных соединений минералов, дайте их названия и синонимы):
Галит – NaCl
Сильвин – КCl
сильвинит – nNaCl + mKCl+ примеси
флюорит – CaF2
6. Получение галогенов электролизом: Cl2.

7. Заполните таблицу «Применение хлора».
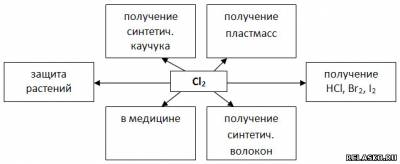
|
| |
| |
| Родион | Дата: Пятница, 02.10.2015, 10:33 | Сообщение # 47 |
|
Подполковник
Группа: Проверенные
Сообщений: 125
Награды: 0
Репутация: 0
Статус: Offline
| Часть II
1. Максимально возможную степень окисления хлор проявляет в соединении с формулой:
3) Cl2O7
2. Характерными степенями окисления хлора являются:
1) -1, +1, +3, +5, +7
3. Степень окисления хлора увеличивается в ряду веществ:
3) Ca(ClO)2, KClO3, HСlO4
4. Самый сильный окислитель-галоген – это фтор, который в результате восстановления получает с.о. -1. Самый сильный восстановитель – это йод, который в результате окисления получает максимальную с.о. +7.
5. Йод способен переходить из твёрдого состояния в газообразное, минуя жидкое,- это явление сублимация или возгонка.
6. Из бромида натрия можно получить бром:
1) электролизом NaBr, схема которого
ток
2NaBr→2Na+Br2
2) реакцией замещения Br2+NaI, уравнение которой
Br2+2NaI→2NaBr+I2
7. Дополните схему реакции. Расставьте коэффициенты в реакции методом электронного баланса.
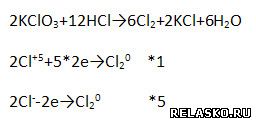
8. С помощью дополнительных источников информации, в том числе Интернета, подготовьте небольшое сообщение об истории открытия и значении одного из галогенов. Составьте план сообщения или запишите тезисы в особой тетради.
Йод был открыт в 1811 г. Куртуа в золе морских водорослей, а с 1815 г. Гей-Люссак стал рассматривать его как химический элемент.
Йод находится в виде иодидов в морской воде. Присутствует в живых организмах, больше всего в водорослях (ламинарии). Известен в природе также в свободной форме, в качестве минерала.
Применение
• 5% спиртовой раствор йода используется для дезинфекции кожи вокруг повреждения, но не для приема внутрь при дефиците йода в организме.
• В рентгенологических исследованиях широко применяются йодсодержащие контрастные препараты.
• В криминалистике пары йода применяются для обнаружения отпечатков пальцев на бумажных поверхностях, например на купюрах.
• Лазерный синтез.
• Производство аккумуляторов.
• Источники света.
Значение
У животных и человека йод входит в состав гормонов, вырабатываемых щитовидной железой, оказывающих важное воздействие на рост, развитие и обмен веществ организма. Суточная потребность человека в йоде определяется возрастом, физиологическим состоянием и массой тела. Для человека среднего возраста нормальной комплекции суточная доза йода составляет 0,15 мг.
Отсутствие или недостаток йода в рационе приводит к заболеваниям (эндемический зоб, кретинизм, гипотиреоз). Также при небольшом недостатке йода отмечается усталость, головная боль, подавленное настроение, природная лень, нервозность и раздражительность; слабеет память и интеллект. Со временем появляется аритмия, повышается артериальное давление, падает уровень гемоглобина в крови.
В связи с этим к поваренной соли, поступающей в продажу в местностях с дефицитом йода, с профилактической целью добавляют иодид калия, иодид натрия или йодат калия (йодированная соль).
|
| |
| |
| Родион | Дата: Пятница, 02.10.2015, 10:40 | Сообщение # 48 |
|
Подполковник
Группа: Проверенные
Сообщений: 125
Награды: 0
Репутация: 0
Статус: Offline
| Тема 23. Соединения галогенов.
Часть I
1. Галогеноводороды имеют общую формулу НГ.
Электронная формула -
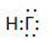
Структурная формула - Н-Г
Химическая связь – ковалентная полярная.
Физические свойства НГ – в группе сверху вниз возрастает плотность, интнсивность окраса
Водные растворы НГ – это соответствующие бескислородные кислоты.
Прочность молекул НГ ↓ в ряду:
HF→HCl→HBr→HI, а α (сила кислот) ↑ в этом ряду.
Синонимы названий:
HCl – соляная кислота
HF – плавиковая кислота
2. Соляная кислота (классификационная характеристика):
1) по кислороду – бескислородная
2) по водороду – одноосновная
3) по степени диссоциации – сильная
4) по прочности – стойкая
5) по растворимости – растворимая
6) по летучести – летучая
Проявляет типичные свойства кислот – взаимодействует (составьте уравнения возможных реакций – молекулярные, полные и сокращённые ионные):

Получение HCl:
1) в промышленности (название и схема процесса)
а) H2+Cl2→2HCl (синтез)
б) синтез HCl из водорода и хлора
2) в лаборатории:
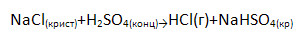
Объясните, почему возможна эта реакция, ведь образуются растворимые продукты.
Т.к. в системе нет воды, то HCl не переходит в соляную кислоту, а ↑ в виде газа.
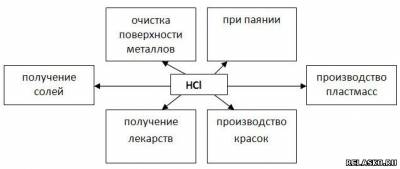
3. Заполните схему «Применение HCl».
4. Качественная реакция на ионы Г-:

Запишите по одному молекулярному уравнению реакции и галогенид-ионы:

|
| |
| |
| Родион | Дата: Пятница, 02.10.2015, 10:42 | Сообщение # 49 |
|
Подполковник
Группа: Проверенные
Сообщений: 125
Награды: 0
Репутация: 0
Статус: Offline
| Часть II
1. Самая сильная кислородсодержащая кислота – HСlO4. Ей соответствует оксид Cl2O7. Он проявляет типичные кислотные свойства. Подтвердите уравнениями соответствующих реакций:
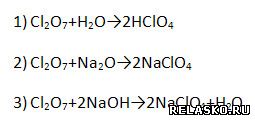
2. Методом электронного баланса уравняйте реакцию, схема которой:

3. Методом электронного баланса уравняйте реакцию, схема которой:
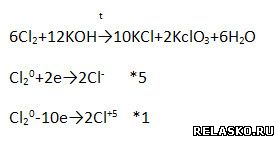
4. В уравнениях диссоциации хлорсодержащих кислот допущено две ошибки. Исправьте их.
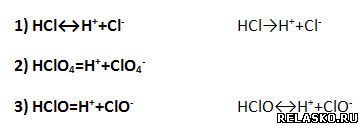
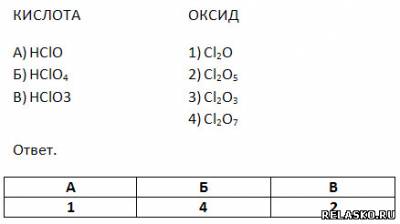
5. Установите соответствие между формулами кислот и соответствующих им кислотных оксидов.
6. Как с помощью одного реактива распознать растворы фторида, хлорида, бромида и иодида натрия?
Добавить в них AgNO3, получатся соли разного цвета.
7. Дополните цепочку переходов. Составьте уравнения реакций, с помощью которых можно осуществить превращения по схеме:
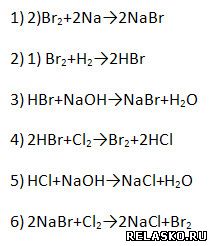
|
| |
| |
| Родион | Дата: Пятница, 02.10.2015, 10:45 | Сообщение # 50 |
|
Подполковник
Группа: Проверенные
Сообщений: 125
Награды: 0
Репутация: 0
Статус: Offline
| Тема 24. Кислород.
Часть I
1. Строение атома

2. Молекулярная формула – О2, другая аллотропная модификация имеет формулу О3 и носит название – озон.
3. Физические свойства кислорода: газ без цвета и запаха, тяжелее воздуха.
4. Химические свойства кислорода.
Взаимодействует (закончите уравнения реакций и рассмотрите их с позиций окисления-восстановления):

5. Получение кислорода:
1) в промышленности – из жидкого воздуха
2) в лаборатории – разложением (закончите уравнения реакций, назовите соединения и процессы, укажите условия их протекания):

3) в природе (запишите уравнение и название процесса):
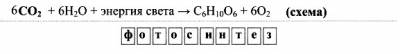
|
| |
| |
| Родион | Дата: Пятница, 02.10.2015, 10:48 | Сообщение # 51 |
|
Подполковник
Группа: Проверенные
Сообщений: 125
Награды: 0
Репутация: 0
Статус: Offline
| Часть II
1. Заполните схему «Применение кислорода».
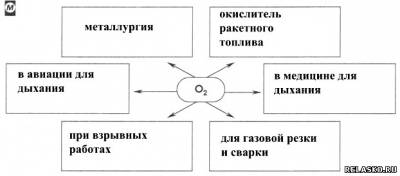
2. С помощью Интернета подготовьте небольшое сообщение по теме «Интенсификация металлургических и других промышленных процессов с помощью кислорода». Запишите план или тезисы сообщения в особой тетради.
Кислород в металлургии широко применяется для интенсификации ряда металлургических процессов. Полная или частичная замена поступающего в металлургические агрегаты воздуха кислородом изменила химизм процессов, их технические параметры. Кислородное дутье позволило сократить потери тепла с уходящими газами, значительная часть которых при воздушном дутье составлял азот, который замедлял течение реакций. При продувке кислородом снижается расход топлива, улучшается качество металла, в металлургических агрегатах возможно получение новых видов продукции (например, шлаков и газов необычного для данного процесса состава, находящих специальное техническое применение) и др.
Большие перспективы имеет интенсификация металлургических процессов путем введения в металлургические агрегаты (доменная печь, конвертор, мартеновская печь) воздуха, обогащенного кислородом. Применение кислородного дутья повышает температуру процесса, уменьшает содержание вредных газов в стали, повышая тем самым ее механические качества. Уменьшение общего количества газов при кислородном дутье уменьшает и потерю теплоты, уносимой газами. Кислородное дутье сокращает время продувки, повышая производительность конвертора.
3. Запишите схемы реакций, протекание которых возможно. Рассмотрите уравнения реакций с позиций окисления-восстановления.

4. В лаборатории собирают кислород в сосуд с помощью вытеснения воды или воздуха. Распознают с помощью тлеющей лучинки, которая загорается (вспыхивает).
5. Сравните свойства и области применения кислорода и озона.
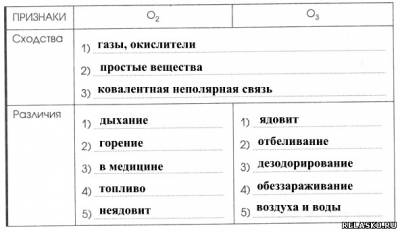
6. Дополните цепочку переходов. Составьте уравнения реакций, с помощью которых можно осуществить превращения по схеме:

7. Придумайте и запишите условия задачи на нахождение объёма воздуха, необходимого для сжигания известного объёма этана (С2Н2). Решите задачу, используя правило Гей-Люссака.
Найти объём воздуха, необходимого на сжигание 44,8 л С2Н2 (н.у.)?

|
| |
| |
| Родион | Дата: Пятница, 02.10.2015, 10:53 | Сообщение # 52 |
|
Подполковник
Группа: Проверенные
Сообщений: 125
Награды: 0
Репутация: 0
Статус: Offline
| Тема 25. Сера.
Часть I
1. Строение атома
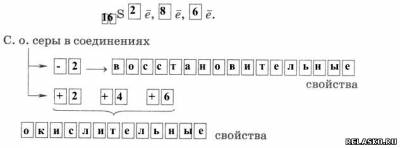
2. 
Наиболее устойчива сера ромбическая, имеющая формулу S8.
Физические свойства данной модификации: лимонного цвета, полупрозрачны, температура плавления 112,8 ⁰С, октаэдры со срезанными углами.
3. Химические свойства серы (закончите уравнения реакций и рассмотрите их с позиций окисления-восстановления):

4. Заполните таблицу «Сера в природе».
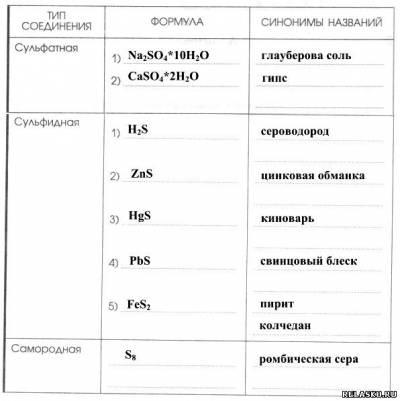
|
| |
| |
| Родион | Дата: Пятница, 02.10.2015, 10:56 | Сообщение # 53 |
|
Подполковник
Группа: Проверенные
Сообщений: 125
Награды: 0
Репутация: 0
Статус: Offline
| Часть II
1. Заполните схему «Применение серы».
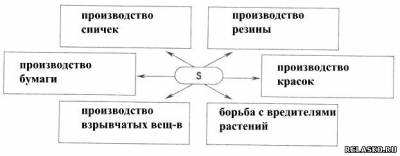
2. Опишите, как происходит превращение одних модификаций серы в другие.
При кристаллизации из расплава сначала получается моноклинная сера, она потом переходит в ромбическую. Если вылить горячую серу в холодную воду, она застывает в виде резины – пластическая сера.
3. Запишите уравнения реакций переходов, расшифровав неизвестные формулы.

4. Напишите синквейн на тему «Сера».
1) Сера.
2) Жёлтая, нерастворимая.
3) Моноклинная, ромбическая, пластическая.
4) Основа спичек, бумаги, пороха.
5) Серная кислота.
5. Вычислите, какой объём воздуха потребуется для сжигания 250 м3 сероводорода. Какой объём оксида серы (IV) при этом образуется?

|
| |
| |
| Родион | Дата: Пятница, 02.10.2015, 11:07 | Сообщение # 54 |
|
Подполковник
Группа: Проверенные
Сообщений: 125
Награды: 0
Репутация: 0
Статус: Offline
| Тема 26. Бинарные соединения серы.
Часть I
1. Сероводород.
1) Строение молекулы:
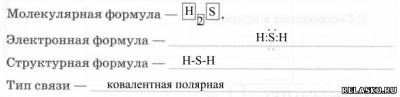
2) Физические свойства: бесцветный газ, с резким запахом тухлых яиц, тяжелее воздуха.
3) Химические свойства (закончите уравнения реакций и рассмотрите уравнения в свете ТЭД или с позиций окисления-восстановления).

4) Сероводород в природе: в виде соединений – сульфидов, в свободном виде – в вулканических газах.
2. Оксид серы (IV) – SO2
1) Получение в промышленности. Запишите уравнения реакций и рассмотрите их с позиций окисления-восстановления.

2) Получение в лаборатории. Запишите уравнение реакции и рассмотрите её в свете ТЭД:
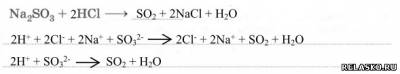
3) Физические свойства: газ с резким удушливым запахом.
4) Химические свойства. Проявляет типичные свойства кислотных оксидов:

3. Оксид серы (VI)- SO3.
1) Получение синтезом из оксида серы (IV):

2) Физические свойства: жидкость, тяжелее воды, в смеси с серной кислотой – олеум.
3) Химические свойства. Проявляет типичные свойства кислотных оксидов:
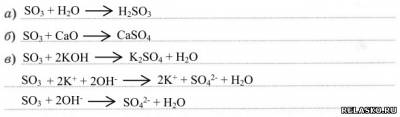
|
| |
| |
| Родион | Дата: Пятница, 02.10.2015, 11:14 | Сообщение # 55 |
|
Подполковник
Группа: Проверенные
Сообщений: 125
Награды: 0
Репутация: 0
Статус: Offline
| Часть II
1. Охарактеризуйте реакцию синтеза оксида серы (VI) по всем классификационным признакам.
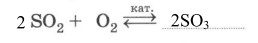
а) каталитическая
б) обратимая
в) ОВР
г) соединения
д) экзотермическая
е) горения
2. Охарактеризуйте реакцию взаимодействия оксида серы (IV) с водой по всем классификационным признакам.

а) обратимая
б) соединения
в) не ОВР
г) экзотермическая
д) некаталитическая
3. Объясните, почему сероводород проявляет сильные восстановительные свойства.
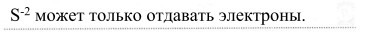
Подтвердите этот тезис уравнениями соответствующих реакций.

4. Объясните, почему оксид серы (IV) может проявлять как окислительные, так и восстановительные свойства:
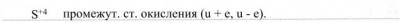
Подтвердите этот тезис уравнениями соответствующих реакций.

5. Сера вулканического происхождения образуется в результате взаимодействия сернистого газа и сероводорода. Запишите уравнения реакции и рассмотрите с позиций окисления-восстановления.

6. Запишите уравнения реакций переходов, расшифровав неизвестные формулы:

7. Напишите синквейн на тему «Сернистый газ».
1) Сернистый газ
2) Удушливый и резкий
3) Кислотный оксид, ОВР
4) Используется для получения SO3
5) Серная кислота H2SO4
8. Используя дополнительные источники информации, в том числе и Интернет, подготовьте сообщение о токсичности сероводорода (обратите внимание на его характерный запах!) и первой помощи при отравлении этим газом. Запишите план сообщения в особой тетради.
Сероводород
Бесцветный газ с запахом тухлых яиц. Обнаруживается в воздухе по запаху даже в малых концентрациях. В природе встречается в воде минеральных источников, морей, вулканических газах. Образуется при разложении белков без доступа кислорода. Может выделяться в воздух в ряде производств химической, текстильной промышленности, при добыче и переработке нефти, из канализации.
Сероводород — сильный яд, вызывающий острые и хронические отравления. Оказывает местное раздражающее и общетоксическое действие. При концентрации 1,2 мг/л отравление развивается молниеносно, смерть наступает вследствие острого угнетения процессов тканевого дыхания. При прекращении воздействия даже при тяжелых формах отравления пострадавший может быть возвращен к жизни.
При концентрации 0,02—0,2 мг/л наблюдается головная боль, головокружение, стеснение в груди, тошнота, рвота, понос, потеря сознания, судороги, поражение слизистой оболочки глаз, конъюнктивит, светобоязнь. Опасность отравления увеличивается в связи с потерей обоняния. Постепенно нарастает сердечная слабость и нарушение дыхания, коматозное состояние.
Первая помощь — удаление пострадавшего из загрязненной атмосферы, вдыхание кислорода, искусственное дыхание; средства, возбуждающие дыхательный центр, согревание тела. Рекомендуются также глюкоза, витамины, препараты железа.
Профилактика — достаточная вентиляция, герметизация некоторых производственных операций. При спуске рабочих в колодцы и емкости, содержащие сероводород, они должны обязательно пользоваться противогазами и спасательными поясами на тросах. Обязательна газоспасательная служба в шахтах, в местах добычи и на предприятиях по переработке нефти.
|
| |
| |
| Родион | Дата: Пятница, 02.10.2015, 11:28 | Сообщение # 56 |
|
Подполковник
Группа: Проверенные
Сообщений: 125
Награды: 0
Репутация: 0
Статус: Offline
| Тема 27. Серная кислота.
Часть I
1. Серная кислота H2SO4 (классификационная характеристика):
1) по кислороду – кислородсодержащая
2) по водороду – двухосновная
3) по степени диссоциации – сильная
4) по прочности – прочная
5) по растворимости – растворимая
6) по летучести – летучая
2. Физические свойства: тяжёлая маслянистая жидкость
Свойство поглощать воду – гигроскопичность.
Прибор для осушения газов – сепаратор.
3. Правило разбавления (выбрать верное)
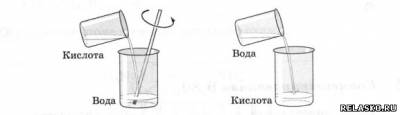
Правильно- в первом случае.
Объясните свой выбор. Реакция экзотермическая, возможно закипание воды и её выброс.
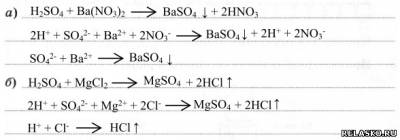
4. Химические свойства – типичные свойства кислот проявляет разбавленная H2SO4. Запишите уравнения реакций в молекулярной , полной и сокращённой ионной формах:
1) с металлами:
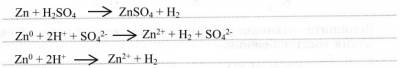
2) с основными и амфотерными оксидами:
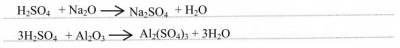
3) с основаниями:
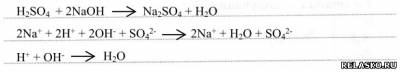
4) с солями с образованием ↑ или ↓:
5. Концентрированная H2SO4:
1) обугливает органические вещества;
2) взаимодействует с металлами, расположенными до и после H2 в ряду напряжений металлов, образуя соль, воду и один из продуктов восстановления.

Запишите уравнение реакции и рассмотрите с позиций окисления-восстановления.

6. Химические процессы производства серной кислоты можно представить схемой получения в три стадии:

Запишите уравнения реакций и рассмотрите с позиций окисления-восстановления.

|
| |
| |
| Родион | Дата: Пятница, 02.10.2015, 11:34 | Сообщение # 57 |
|
Подполковник
Группа: Проверенные
Сообщений: 125
Награды: 0
Репутация: 0
Статус: Offline
| Часть II
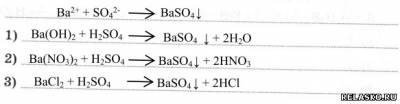
1. Запишите сокращённое ионное уравнение качественной реакции на сульфат-ион и составьте три соответствующих молекулярных уравнения.
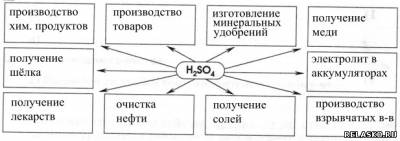
2. Заполните схему «Применение H2SO4».
3. Допишите уравнения реакций и рассмотрите с позиций окисления-восстановления.

4. Запишите уравнения реакций, с помощью которых можно осуществить превращения по схеме:

5. Концентрированную серную кислоту перевозят в стальных и алюминиевых цистернах, потому что она не взаимодействует с Fe и Al при обычных условиях.
6. Запишите определение.
Олеум – это раствор SO3 в серной кислоте.
7. Подготовьте презентацию о производстве серной кислоты или использовании в народном хозяйстве. Составьте и запишите план презентации в особой тетради.
|
| |
| |
| Родион | Дата: Понедельник, 05.10.2015, 10:09 | Сообщение # 58 |
|
Подполковник
Группа: Проверенные
Сообщений: 125
Награды: 0
Репутация: 0
Статус: Offline
| Тема 28. Соли серной кислоты.
Часть I
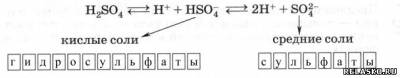
1. Как двухосновная, H2SO4 диссоциирует ступенчато, а потому образует два ряда солей:
2. Кристаллогидраты – это кристаллические вещества, содержащие молекулы H2O.
Примеры формул и названия:

3. Реактивом, с помощью которого можно распознать соли серной кислоты, так и саму кислоту, является раствор
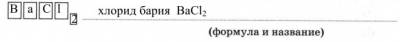
Ионное уравнение качественной реакции на сульфат-ион:
4. Заполните таблицу «Применение солей H2SO4».

|
| |
| |
| Родион | Дата: Понедельник, 05.10.2015, 10:32 | Сообщение # 59 |
|
Подполковник
Группа: Проверенные
Сообщений: 125
Награды: 0
Репутация: 0
Статус: Offline
| Часть II
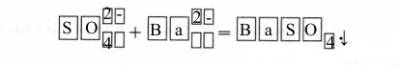
1. Предложите способы распознавания растворов солей натрия – сульфида, сульфита и сульфата – и запишите уравнения соответствующих реакций в молекулярной и ионной формах.
2. Соли бария очень ядовиты, но сульфат бария используется в рентгенологии, потому что может задерживать рентгеновские лучи (для диагностики).
3. Стоматологи и скульпторы используют полуводный гипс, или алебастр, в своей практике, потому что в смеси с водой полуводный гипс быстро твердеет, превращаясь снова в двуводный гипс.
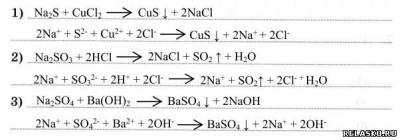
4. Запишите уравнения реакций согласно схеме. Составьте уравнения реакций в молекулярной и ионной формах.
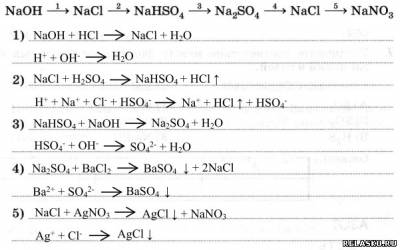
5. Запишите уравнения реакций четырёх способов получения сульфата железа (II).

6. Рассчитайте массовую долю соли в растворе, полученном при растворении 50 г медного купороса в 320 г воды.

7. Установите соответствие между формулами бинарных соединений и солей.

|
| |
| |
| Родион | Дата: Понедельник, 05.10.2015, 10:38 | Сообщение # 60 |
|
Подполковник
Группа: Проверенные
Сообщений: 125
Награды: 0
Репутация: 0
Статус: Offline
| Тема 29. Азот.
Часть I
1. Строение атома –

2. Строение молекулы.
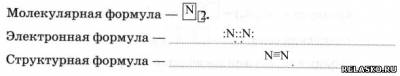
3. Характеристика химической связи в молекуле:
- по ЭО ковалентная неполярная;
- по кратности тройная.
4. Физические свойства: газ, входит в состав воздуха, без цвета и запаха, инертен.
5. Химические свойства.
1) Окислительные по отношению к М и Н2. Запишите уравнения реакций и рассмотрите их с позиций окисления-восстановления.

2) Восстановительные свойства
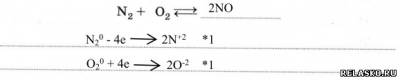
6. Азот в природе.
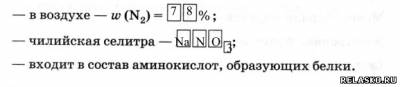
7. Получение в промышленности: из жидкого воздуха
Читать продолжение решебника...
|
| |
| |