|
ГДЗ по Химии. 9 класс. Габриелян. Рабочая тетрадь
|
|
| Родион | Дата: Понедельник, 05.10.2015, 10:41 | Сообщение # 61 |
|
Подполковник
Группа: Проверенные
Сообщений: 125
Награды: 0
Репутация: 0
Статус: Offline
|
Часть II
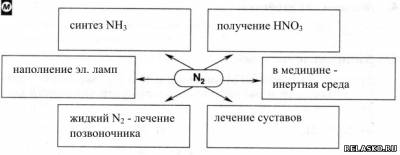
1. Заполните схему «Применение азота».
2. Приведите полную классификационную характеристик у реакции синтеза аммиака.

3. Приведите полную классификационную характеристик у реакции синтеза оксида азота (II).

4. Определите формулы неизвестных реагентов и запишите уравнения реакций для переходов:
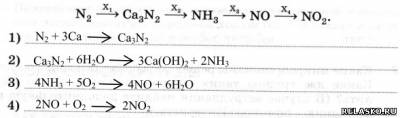
5. Какой объём азота можно получить из 540 м3 воздуха путём его фракционной перегонки?

6. Вычислите массу полученного в задании 5 объёма азота.

7. Какие микроорганизмы решают проблему связанного азота? Какие две группы таких микроорганизмов можно выделить? (в случае затруднения найдите дополнительную информацию с помощью Интернета.)
1) Клубеньковые азотфиксирующие бактерии, связывающие свободный атом N2 в усваиваемую форму.
2) Почвенные водоросли, в частности, сине-зеленые – также связывают атмосферный азот.
8. Напишите синквейн о веществе азоте.
1) азот N2
2) бесцветный, без запаха
3) инертен, неметалл
4) получают из жидкого воздуха
5) воздух
|
| |
| |
| Родион | Дата: Понедельник, 05.10.2015, 10:47 | Сообщение # 62 |
|
Подполковник
Группа: Проверенные
Сообщений: 125
Награды: 0
Репутация: 0
Статус: Offline
| Тема 30. Аммиак.
Часть I
1. Строение молекулы.

2. Физические свойства: газ без цвета с резким запахом.
3. Водородная связь – это межмолекулярные или внутримолекулярные связи между атомом водорода и атомом сильно ЭО атомом.
4. Получение, собирание и распознавание NH3.
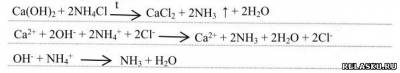
1) Напишите уравнение получения аммиака в лаборатории в молекулярной и ионной формах:
2) Получение в промышленности:

Укажите верный способ собирания аммиака, ответ поясните.

б, т.к. NH3 легче воздуха, он будет собираться в пробирке в верхней части.
3) Как можно тремя разными способами распознать аммиак?
а) запах
б) посинение влажной лакмусовой бумаги
в) белый дым на палочке над HCl.
5. Химические свойства.
1) Является сильным восстановителем, потому что N-3 может только отдавать электроны.
Восстановительные свойства проявляет по отношению (запишите уравнения реакций и рассмотрите с позиций окисления-восстановления):
- к кислороду:

- к оксидам металлов:

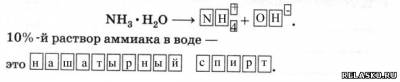
2) Взаимодействует с водой, образуя непрочное основание – гидрат аммиака NH3*H2O, который, как слабый электролит, незначительно диссоциирует:
3) Взаимодействует с кислотами, образуя соли аммония по донорно-акцепторному механизму:
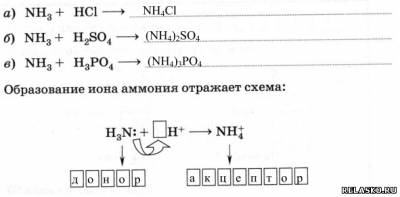
Различают два механизма образования ковалентной связи:
1) обменный;
2) донорно-акцепторный.
|
| |
| |
| Родион | Дата: Понедельник, 05.10.2015, 10:52 | Сообщение # 63 |
|
Подполковник
Группа: Проверенные
Сообщений: 125
Награды: 0
Репутация: 0
Статус: Offline
| Часть II
1. Заполните схему «Применение аммиака».
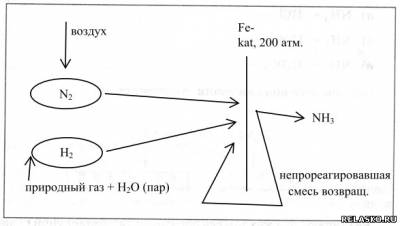
2. Зарисуйте схему промышленного синтеза аммиака, укажите сырьё и происходящие процессы.
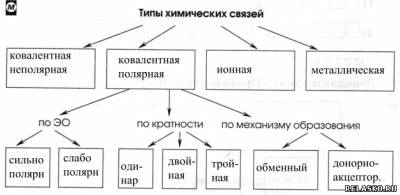
3. Заполните схему «Типы химических связей».
4. Предложите три молекулярных уравнения, отражающих качественную реакцию на ион аммония:
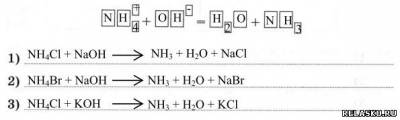
5. Заполните таблицу.

6. Какой объём аммиака образуется при взаимодействии 535 г 20-%-го раствора аммония с щёлочью?

7. Запишите уравнения реакций для следующих переходов:
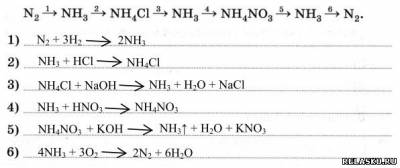
|
| |
| |
| Родион | Дата: Понедельник, 05.10.2015, 10:54 | Сообщение # 64 |
|
Подполковник
Группа: Проверенные
Сообщений: 125
Награды: 0
Репутация: 0
Статус: Offline
| Тема 31. Соли аммония.
Часть I
1. Соли аммония – это соли, образованные ионом NH4+ и кислотным остатком.
2. Предложите общую формулу для солей аммония, обозначив кислотный остаток символом Acdn:

3. Физические свойства солей аммония: белые кристаллические вещества.
4. Конкретизируйте схему «Химические свойства солей аммония» уравнениями соответствующих реакций.
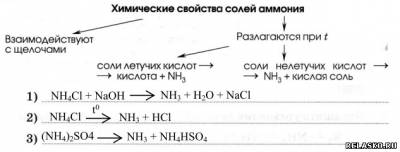
5. Заполните таблицу «Применение солей аммония».
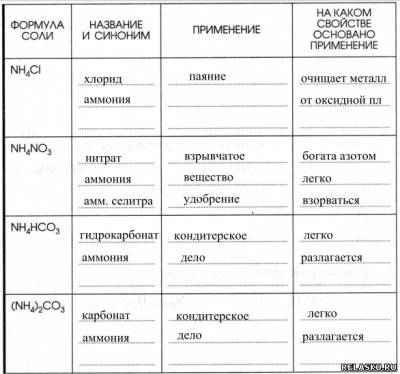
|
| |
| |
| Родион | Дата: Понедельник, 05.10.2015, 10:57 | Сообщение # 65 |
|
Подполковник
Группа: Проверенные
Сообщений: 125
Награды: 0
Репутация: 0
Статус: Offline
| Часть II
1. Как распознать растворы хлорида, сульфата и карбоната аммония? Предложите ход анализа и напишите уравнения соответствующих реакций в молекулярном и ионном видах.
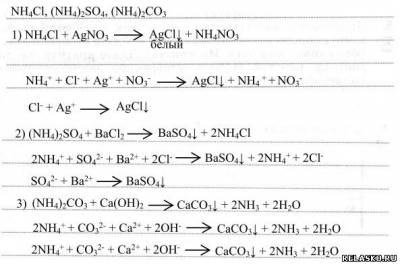
2. Составьте уравнения реакций для переходов:
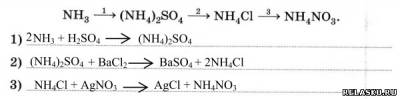
3. Рассмотрите ОВР, схема которой:

5. Предложите классификацию азотных удобрений (используйте приложение к учебнику или найдите необходимую информацию с помощью Интернета). Дайте краткую характеристику каждой группы удобрений, заполнив таблицу «Классификация удобрений».
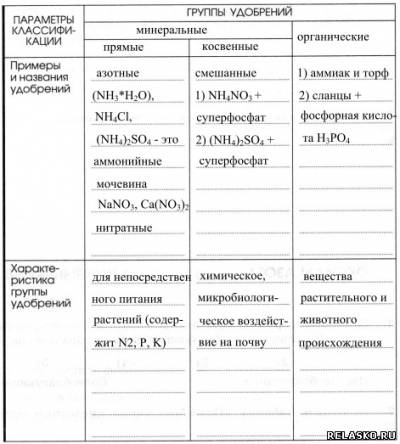
6. Сравните содержание азота в хлориде, сульфате и нитрате аммония. Какое из перечисленных соединений представляет большую ценность для минерального питания растений? Только ли по этой причине вы можете рекомендовать его к применению?
NH4Cl, (NH4)2SO4 и NH4NO3

7. Напишите синквейн об одной из солей аммония.
1. NH4Cl
2. белая, кристаллическая
3. имеет запах аммиака
4. используют в качестве удобрений
5. паяние
|
| |
| |
| Родион | Дата: Понедельник, 05.10.2015, 11:03 | Сообщение # 66 |
|
Подполковник
Группа: Проверенные
Сообщений: 125
Награды: 0
Репутация: 0
Статус: Offline
| Тема 32. Оксиды азота.
Часть I
1. Запишите формулы пяти оксидов азота и фигурными скобками объедините соле-образующие и не соле-образующие.

2. Заполните таблицу «Солеобразующие кислотные оксиды азота».
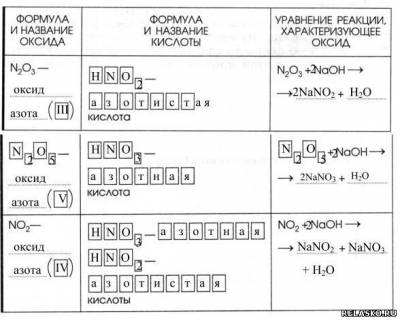
3. Физические свойства:
1) NO газ, тяжелее воздуха, Mr(NO)=30
2) NO2 бурый, ядовитый газ.
4. Классификационная характеристика HNO3:
1) по водороду – одноосновная
2) по кислороду – кислородсодержащая
3) по растворимости – растворимая
4) по степени диссоциации – сильная
5. Химические свойства HNO3 как электролита конкретизируйте уравнениями реакций в молекулярной, полной и сокращённой ионной формах:
1) с основными оксидами
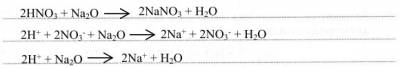
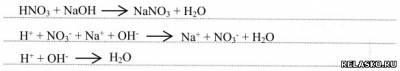
2) с гидроксидами металлов
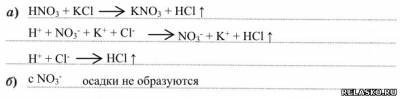
3) с солями с образованием ↑ или ↓
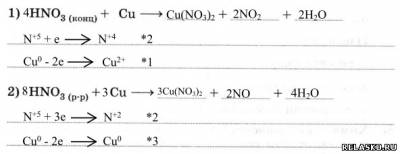
6. Окислительные свойства HNO3: взаимодействует с металлами, стоящими до и после Н2 в ряду напряжений металлов, образуя соль, воду и какой-либо продукт восстановления N+5.
Рассмотрите ОВР, схемы которых:
|
| |
| |
| Родион | Дата: Понедельник, 05.10.2015, 11:06 | Сообщение # 67 |
|
Подполковник
Группа: Проверенные
Сообщений: 125
Награды: 0
Репутация: 0
Статус: Offline
| Часть II
1. Запишите уравнения реакций получения азотной кислоты электродуговым способом:

Почему этот способ так называется?
Потому что реакция идёт только при температуре электрической дуги.
2. Запишите первое уравнение реакции получения азотной кислоты аммиачным способом:
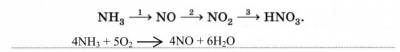
Чем этот способ отличается от электродугового?
Идёт при низкой температуре, в присутствии катализатора.
3. Допишите уравнения реакций. Расставьте коэффициенты методом электронного баланса.
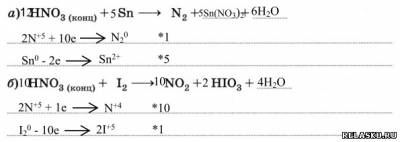
6. Придумайте и решите задачу на нахождение объёма оксида азота (II), полученного путём взаимодействия разбавленной азотной кислоты с известной массой меди, содержащей долю примесей в виде оксида меди (II).
Найти объём NO, который получили из меди и разбавленной HNO3, если медь содержит 10% примесей CuO, a m(Cu прим)=128 г.

7. Напишите синквейн об азотной кислоте.
1. Азотная кислота
2. Сильная и разъедающая
3. Разъедает кожу
4. Основа удобрений
5. Соли азотной кислоты
|
| |
| |
| Родион | Дата: Понедельник, 05.10.2015, 11:09 | Сообщение # 68 |
|
Подполковник
Группа: Проверенные
Сообщений: 125
Награды: 0
Репутация: 0
Статус: Offline
| Тема 33. Соли азотной кислоты.
Часть I
1. Предложите общую формулу для солей азотной кислоты, обозначив катион металла через Mn+:

2. Селитры – это нитраты калия, натрия и аммония.
3. Физические свойства нитратов: кристаллические вещества, хорошо растворяются в воде.
4. Заполните таблицу «Применение нитратов».
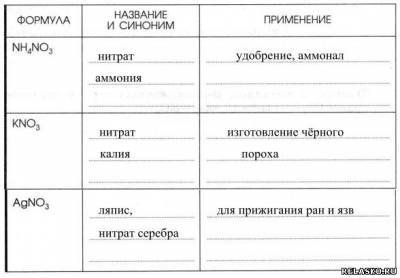
5. Общее химическое свойство нитратов: разлагаются при нагревании (конкретизируйте уравнениями соответствующих реакций, рассмотрите с позиций окисления-восстановления):

|
| |
| |
| Родион | Дата: Понедельник, 05.10.2015, 11:11 | Сообщение # 69 |
|
Подполковник
Группа: Проверенные
Сообщений: 125
Награды: 0
Репутация: 0
Статус: Offline
| Часть II
1. Допишите уравнение реакции (а). Расставьте коэффициенты методом электронного баланса.

2. Закончите уравнения реакций термического разложения нитратов:
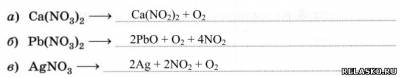
3. Запишите уравнения реакций для переходов:
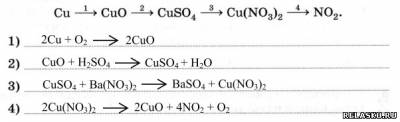
4. Рассчитайте массу ляписа, содержащего 20% примесей, если при его разложении на свету было получено 162 мг серебра.

5. Какой объём (н.у.) займёт кислород, полученный при разложении 303 г нитрата калия?

6. Напишите в особой тетради миниатюру «Художественный образ одного из соединений азота».
|
| |
| |
| Родион | Дата: Понедельник, 05.10.2015, 11:19 | Сообщение # 70 |
|
Подполковник
Группа: Проверенные
Сообщений: 125
Награды: 0
Репутация: 0
Статус: Offline
| Тема 34. Фосфор.
Часть I
1. Строение атома

2.
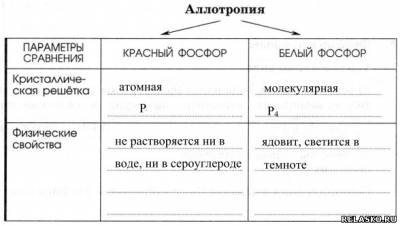
3. Химические свойства.
Допишите уравнения реакций, рассмотрите их с позиций окисления-восстановления.
1) Окислительные свойства по отношению к металлам: образуются бинарные соединения – фосфиды.

2) Восстановительные свойства по отношению к кислороду, более электроотрицательным НМ и сильным окислителям:

4. Фосфор в природе.
1) в свободном виде – нет
2) основная часть минералов (фосфоритов и апатитов) и костей позвоночных животных (формула и название соли)

5. Получение (рассмотрите с позиций окисления-восстановления):

|
| |
| |
| Родион | Дата: Понедельник, 05.10.2015, 11:22 | Сообщение # 71 |
|
Подполковник
Группа: Проверенные
Сообщений: 125
Награды: 0
Репутация: 0
Статус: Offline
| Часть II
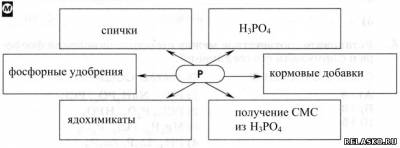
1. Заполните схему «Применение фосфора».
2. Составьте уравнения реакций переходов, расшифровав неизвестные формулы.
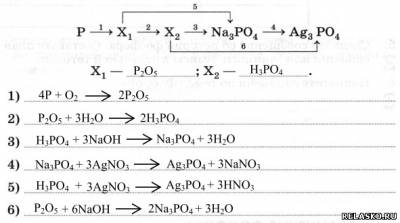
3. Запишите уравнения реакций для переходов:
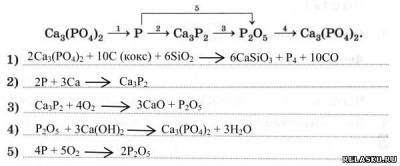
4. Установите соответствие между степенью окисления фосфора и формулами его соединений.
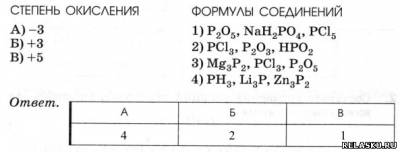
5. Сделайте сообщение об истории фосфора. Составьте план сообщения или запишите тезисы в отдельной тетради.
История фосфора
Фосфор открыт гамбургским алхимиком Х. Брандом в 1669 году. Бранд пытался отыскать философский камень, а получил светящееся вещество.
Бранд проводил опыты с человеческой мочой, так как полагал, что она может содержать золото.
Первоначально его способ заключался в том, что сначала моча отстаивалась в течение нескольких дней, пока не исчезнет неприятный запах, а затем кипятилась до клейкого состояния. Нагревая эту пасту до высоких температур и доводя до появления пузырьков, он надеялся, что, сконденсировавшись, они будут содержать золото.
После нескольких часов интенсивных кипячений получались крупицы белого воскоподобного вещества, которое очень ярко горело и к тому же мерцало в темноте. Бранд назвал это вещество phosphorus mirabilis (лат. «чудотворный носитель света»). Открытие фосфора Брандом стало первым открытием нового элемента со времен античности.
Несколько позже фосфор был получен другим немецким химиком — И. Кункелем.
Независимо от Бранда и Кункеля фосфор был получен Р. Бойлем, описавшим его в статье «Способ приготовления фосфора из человеческой мочи», опубликованной в 1693 году.
Существуют данные, что фосфор умели получать ещё арабские алхимики в XII в.
То, что фосфор — простое вещество, доказал Лавуазье.
6. Напишите синквейн по теме «Фосфор».
1. Фосфор
2. Белый и красный
3. Неметалл, взаимодействует с металлами
4. Производство H3PO4
5. Фосфорные удобрения.
|
| |
| |
| Родион | Дата: Понедельник, 05.10.2015, 11:30 | Сообщение # 72 |
|
Подполковник
Группа: Проверенные
Сообщений: 125
Награды: 0
Репутация: 0
Статус: Offline
| Тема 35. Соединения фосфора.
Часть I
1. Оксид фосфора (V) – P2O5.
Физические свойства – белый гигроскопичный порошок.
Получение (рассмотрите с позиций окисления-восстановления):

Химические свойства типичных кислотных оксидов (напишите уравнения):
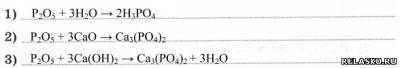
2. Фосфорная кислота – Н3РО4
1) Классификационная характеристика:
а) по водороду – трёхосновная
б) по кислороду – кислородсодержащая
в) по растворимости – растворимая
г) по степени диссоциации – слабая,
поэтому в ионных уравнениях с участием Н3РО4 её записывают в молекулярном виде.
2) Физические свойства: твёрдое, прозрачное, кристаллическое вещество, хорошо растворяется.
3) Химические свойства (напишите уравнения в молекулярной и ионной формах):

4) Получение (уравнение реакции):

3. Соли фосфорной кислоты.
Как трёхосновная, H3PO4 диссоциирует ступенчато в три стадии, поэтому образует три ряда солей.
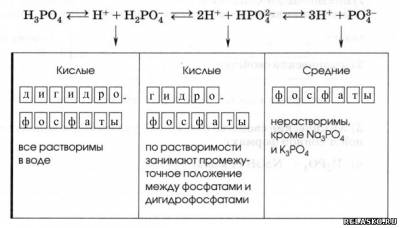
|
| |
| |
| Родион | Дата: Понедельник, 05.10.2015, 11:33 | Сообщение # 73 |
|
Подполковник
Группа: Проверенные
Сообщений: 125
Награды: 0
Репутация: 0
Статус: Offline
| Часть II
1. Верны ли следующие суждения для ряда кислот H3PO4, HPO3, H4P2O7?
А. Ряду кислот соответствует один и тот же кислотный оксид.
Б. Ряду кислот соответствуют оксид фосфора (V) и оксид фосфора (III).
Ответ. 2) верно только А
2. Составьте уравнения реакций, с помощью которых можно осуществить превращения по схеме:

3. Предложите ход анализа и уравнения соответствующих реакций для распознавания растворов хлорида, иодида и фосфата натрия.
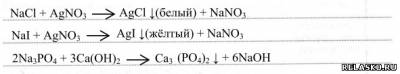
4. При производстве фосфорных удобрений используется фосфатный метод получения фосфорной кислоты (закончите уравнение реакции):
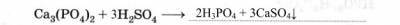
Эта кислота содержит примесь (запишите формулу соединения) CaSO4,
потому что сульфат кальция не растворяется в H3PO4.
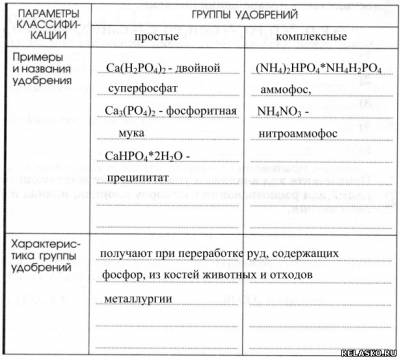
5. Предложите классификацию фосфорных удобрений, используя приложение к учебнику или дополнительную информацию, в том числе из Интернета. Дайте краткую характеристику каждой группы удобрений, заполнив таблицу «Классификация фосфорных удобрений».
6. В 320 мл воды растворили оксид фосфора (V), полученный в результате сжигания 155 г фосфора, содержащего 25% оксида фосфора (V) в виде примесей. Найдите массовую долю фосфорной кислоты в полученном растворе.

|
| |
| |
| Родион | Дата: Понедельник, 05.10.2015, 11:36 | Сообщение # 74 |
|
Подполковник
Группа: Проверенные
Сообщений: 125
Награды: 0
Репутация: 0
Статус: Offline
| Тема 36. Углерод.
Часть I
1. Строение атома.
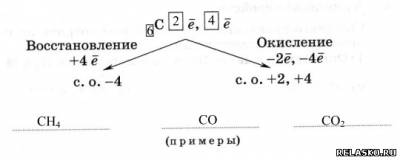
2.
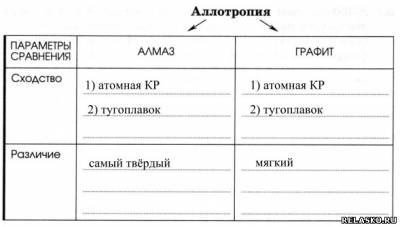
3.
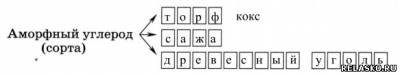
Адсорбция – это способность поглощать газы и растворённые вещества
Активированный уголь (карболен) – это способный поглощать газы, «активный» уголь, обработанный горячим водяным паром.
4. Химические свойства.
Составьте уравнения реакций и рассмотрите их с позиций окисления-восстановления.
1) Окислительные свойства по отношению к Н2 и М.

2) Восстановительные свойства по отношению к кислороду, другим, более электроотрицательным НМ и сложным веществом.

|
| |
| |
| Родион | Дата: Понедельник, 05.10.2015, 11:39 | Сообщение # 75 |
|
Подполковник
Группа: Проверенные
Сообщений: 125
Награды: 0
Репутация: 0
Статус: Offline
| Часть II
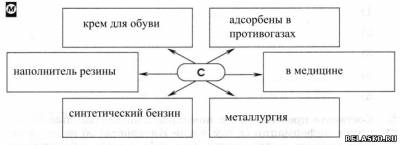
1. Заполните схему «Применение углерода».
2. Заполните схему «Углерод в природе».

3. Запишите уравнения реакций переходов, расшифровав неизвестные формулы:
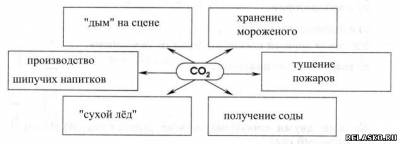
4. Запишите уравнения реакций для переходов:

5. Составьте презентацию с помощью дополнительных источников информации (в том числе Интернета) об использовании алмазов в ювелирном деле или о семи исторических комнатах Алмазного фонда. Запишите план презентации в особой тетради.
6. Напишите синквейн на тему «Углерод».
1. Углерод
2. Алмаз, графит
3. Активированный уголь
4. Фильтр в противогазах
5. Металлургия
7. Придумайте и решите задачу на нахождение объёма углекислого газа (н.у.), полученного в результате сжигания определённой массы углерода, содержащего известную долю примесей.
Найти объём углекислого газа (н.у.), который выделился при сжигании 24 г угля, содержащего 5% примесей.

Читать продолжение решебника...
|
| |
| |