|
Решебник по Химии. 8 класс. Габриелян. Рабочая тетрадь
|
|
| Alicerok | Дата: Вторник, 06.10.2015, 16:51 | Сообщение # 31 |
|
Майор
Группа: Проверенные
Сообщений: 88
Награды: 0
Репутация: 0
Статус: Offline
|
Часть II
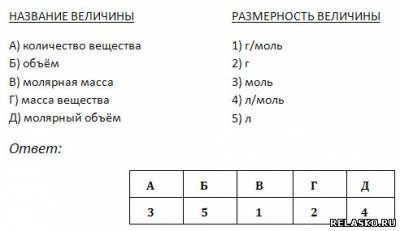
1. Установите соотношение между названием и размерностью величины.
2. Укажите формулы, которые являются производными от основной формулы n = V/Vm.
2) V=n•Vm
3) Vm=V/n
3. Сколько молекул содержат 44,8 л (н. у.) углекислого газа? Решите задачу двумя способами.

4. Придумайте условие задачи, в которой нужно найти число молекул N, если известен объём V.
Найти число частиц оксида азота(II), если его объём равен 67,2 л.
Решите задачу любым способом.

5. Вычислите массу 78,4 л (н. у.) хлора.
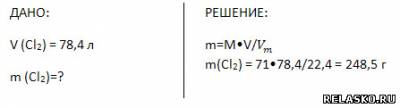

7. Вычислите массу 56 л аммиака, 10% -й водный раствор которого в медицине известен под названием «нашатырный спирт».


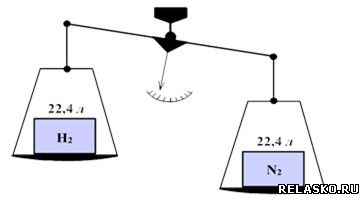
8. Придумайте задачу с использованием изученных понятий. С помощью компьютера создайте рисунок, иллюстрирующий данную задачу. Предложите способ её решения. Верно ли, что 22,4 л азота или 22,4 л водорода одинаковы по массе? Ответ подтвердите вычислениями.

|
| |
| |
| Alicerok | Дата: Вторник, 06.10.2015, 16:58 | Сообщение # 32 |
|
Майор
Группа: Проверенные
Сообщений: 88
Награды: 0
Репутация: 0
Статус: Offline
| Тема 16. Основные и производные единицы измерения количества, массы и объёма веществ.
Часть I
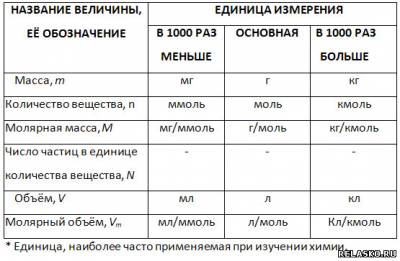
1. Количество вещества измеряют в молях, миллимолях (в 1000 раз меньше 1 моль) и киломолях (в 1000 раз больше 1 моль).
2. Массу измеряют в мг, г, кг.
3. Различают молярную, миллимолярную и киломолярную массы, которые измеряют соответственно в мг/ммоль, г/моль, кг/кмоль.
4. Объём измеряют в мл, л, м3, а миллимолярный, молярный и киломолярный объёмы — в мл/ммоль, л/моль, м3/кмоль.
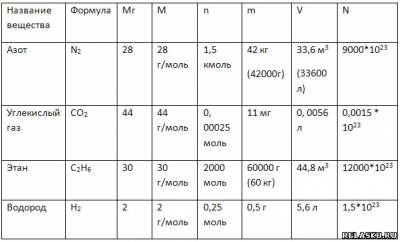
5. Заполните таблицу «Соотношение некоторых физико-химических величин и их единиц».
6. Дополните таблицу, делая необходимые вычисления.
|
| |
| |
| Alicerok | Дата: Вторник, 06.10.2015, 17:02 | Сообщение # 33 |
|
Майор
Группа: Проверенные
Сообщений: 88
Награды: 0
Репутация: 0
Статус: Offline
| Часть II
1. Сколько молекул содержится в 513 мг сахарозы 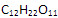 ? ?
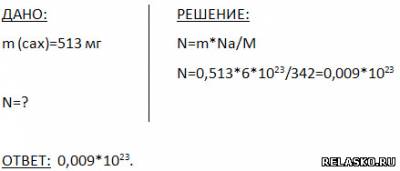
2. Вычислите массу (н. у.) 89,6 м3 азота.

3. Придумайте условие задачи, если масса газообразного вещества дана в килограммах, а требуется найти объём (н. у.).

4. Рассчитайте число молекул в 147 мг серной кислоты.

5. Число молекул метана равно 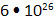 . Вычислите его массу. . Вычислите его массу.
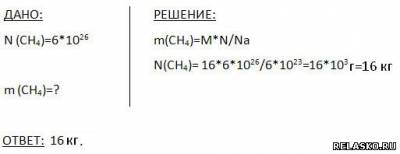
6. Какое количество вещества содержится в 945 мг фосфата кальция Са3(РO4)2?

7. Какой одинаковый объём воздуха (при одинаковых условиях) будет иметь большую массу?
1) сухого воздуха
2) влажного воздуха
Обоснуйте свой выбор.
2)Влажный воздух, так как он будет тяжелее сухого на массу водяных паров, которые содержатся во влажном воздухе.
|
| |
| |
| Alicerok | Дата: Вторник, 06.10.2015, 17:15 | Сообщение # 34 |
|
Майор
Группа: Проверенные
Сообщений: 88
Награды: 0
Репутация: 0
Статус: Offline
| Тема 17. Соединения химических элементов. Степень окисления.
Часть I
1. Степень окисления (с. о.) — это условный заряд атомов химического элемента в сложном веществе, вычисленный на основе предположения, что оно состоит из простых ионов.
Следует знать!
1) В соединениях с. о. водорода = +1, кроме гидридов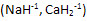
2) В соединениях с. о. кислорода = -2, кроме пероксидов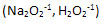 и фторидов и фторидов 
3) Степень окисления металлов всегда положительна.
Для металлов главных подгрупп первых трёх групп с. о. постоянна:
металлы IA группы — с. о. = +1,
металлы IIA группы — с. о. = +2,
металлы IIIA группы — с. о. = +3.
4) У свободных атомов и простых веществ с. о. = 0.
5) Суммарная с. о. всех элементов в соединении = 0.
2. Способ образования названий двухэлементных (бинарных) соединений.

3. 
4. Дополните таблицу «Названия и формулы бинарных соединений».
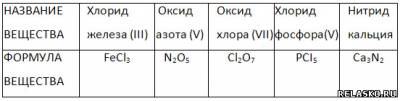
5. Определите степень окисления выделенного шрифтом элемента сложного соединения.
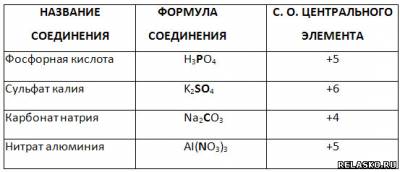
|
| |
| |
| Alicerok | Дата: Вторник, 06.10.2015, 17:17 | Сообщение # 35 |
|
Майор
Группа: Проверенные
Сообщений: 88
Награды: 0
Репутация: 0
Статус: Offline
| Часть II
1. Определите степени окисления химических элементов в соединениях по их формулам. Запишите названия этих веществ.

2. Разделите вещества FeO, Fe2O3, CaCl2, AlBr3, CuO, K2O, BaCl2, SO3 на две группы. Запишите названия веществ, указав степени окисления.
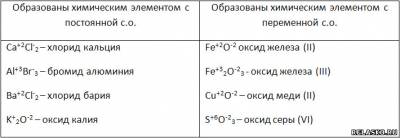
3. Установите соответствие между названием и степенью окисления атома химического элемента и формулой соединения.
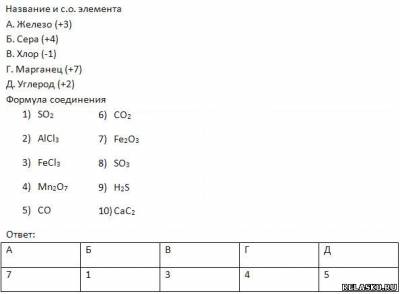
4. Составьте формулы веществ по названию.

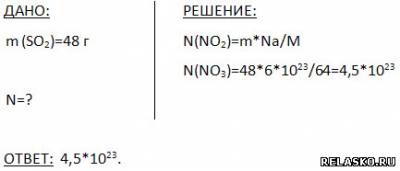
5. Сколько молекул содержится в 48 г оксида серы (IV)?
6. С помощью Интернета и других источников информации подготовьте сообщение о применении какого-либо бинарного соединения по следующему плану:
1) формула;
2) название;
3) свойства;
4) применение.
H2O вода, оксид водорода.
Вода при обычных условиях жидкость, без цвета, запаха, в толстом слое – голубая. Температура кипения около 100⁰С. Является хорошим растворителем. Состоит молекула воды из двух атомов водорода и одного атома кислорода, это его качественный и количественный состав. Это сложное вещество, для него характерны следующие химические свойства: взаимодействие со щелочными металлами, щелочноземельными металлами. Реакции обмена с водой называются гидролизом. Эти реакции имеют большое значение в химии.
7. Степень окисления марганца в соединении К2МnO4 равна:
3) +6
8. Наименьшую степень окисления хром имеет в соединении, формула которого:
1) Сг2O3
9. Максимальную степень окисления хлор проявляет в соединении, формула которого:
3) Сl2O7
|
| |
| |
| Alicerok | Дата: Вторник, 06.10.2015, 17:20 | Сообщение # 36 |
|
Майор
Группа: Проверенные
Сообщений: 88
Награды: 0
Репутация: 0
Статус: Offline
| Тема 18. Оксиды и летучие водородные соединения.
Часть I
1. Признаки оксидов:
- сложные вещества;
- состоят из двух элементов;
- один из элементов - кислород, с. о. -2.
2. Способ образования названий оксидов.
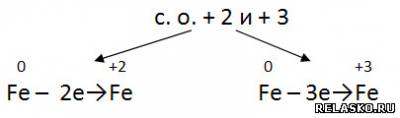
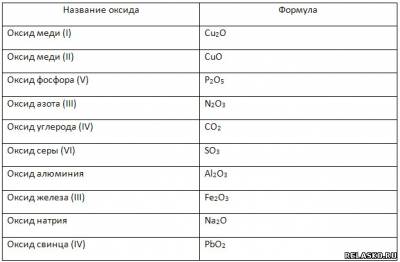
3. Заполните таблицу «Оксиды».
|
| |
| |
| Alicerok | Дата: Вторник, 06.10.2015, 17:24 | Сообщение # 37 |
|
Майор
Группа: Проверенные
Сообщений: 88
Награды: 0
Репутация: 0
Статус: Offline
| Часть II
1. Поиграйте в «крестики-нолики». Покажите выигрышный путь, который составляют формулы высших оксидов элементов IV—VIA групп.

Распределите все приведённые в таблице оксиды на две группы. Запишите их названия.
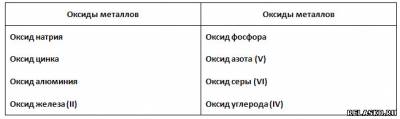
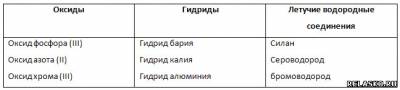
2. Впишите в соответствующие столбцы формулы следующих соединений:
P2O3, BaH2, NO, SiH4, H2S, H2O2, KH, Cr2O3, HBr, AlH3, OF2.
Укажите их названия.
3. Поиграйте в «крестики-нолики». Покажите выигрышный путь, который составляют формулы гидридов.

4. Напишите формулы оксидов и летучих водородных соединений следующих химических элементов:

5. Дополните таблицу.
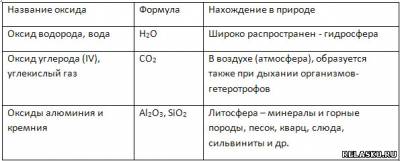
6. Назовите оксиды азота и рассчитайте массовую долю азота в них.

Сделайте вывод: с увеличением с. о. азота в оксиде массовая доля данного химического элемента уменьшается. Постройте схематический график данной зависимости.
7. Сколько м3 содержится в 45,75 кг оксида хлора (VII)?

8. Найдите количество вещества атомов кислорода и атомов фосфора, которое содержится в оксиде фосфора (III) массой 220 г.

|
| |
| |
| Alicerok | Дата: Вторник, 06.10.2015, 17:28 | Сообщение # 38 |
|
Майор
Группа: Проверенные
Сообщений: 88
Награды: 0
Репутация: 0
Статус: Offline
| Тема 19. Основания.
Часть I
1. Признаки оснований:
- сложные вещества;
- состоят из простых ионов металлов (кромеNH4+) и сложных гидроксид — ионов ОН-;
- общая формула оснований: Мn+(ОН)n, где n — заряд иона, равный с. о. металла.
2. Способ образования названий оснований.
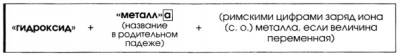
3. с. о. металла +n ← Не путать! → заряд иона n+
с. о. атомов в гидроксид-ионе (O-2Н+)- ← Не путать! → заряд гидроксид-иона ОН-
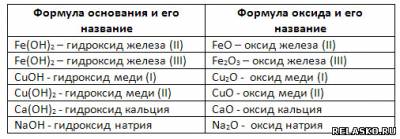
4. Каждому основанию соответствует свой оксид металла. Дополните таблицу «Основания и соответствующие им оксиды».
5. Щёлочи изменяют окраску индикаторов. Дополните таблицу «Изменение окраски индикатора в щелочной среде».

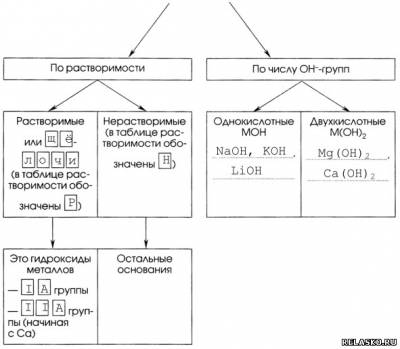
6. Классификация оснований
|
| |
| |
| Alicerok | Дата: Вторник, 06.10.2015, 17:32 | Сообщение # 39 |
|
Майор
Группа: Проверенные
Сообщений: 88
Награды: 0
Репутация: 0
Статус: Offline
| Часть II
1. Поиграйте в «крестики-нолики». Покажите выигрышный путь, который составляют формулы щелочей.
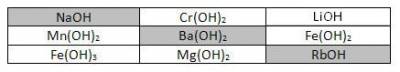
Впишите в соответствующие столбцы формулы и названия всех приведённых выше оснований.
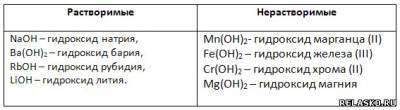
Распределите все приведённые выше основания по другому признаку.
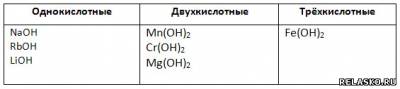
2. Составьте формулы оснований и соответствующих им оксидов металлов для следующих ионов:
1) Ag+ AgOH → Ag2O
2) Pb2+ Pb(OH)2 → PbO
3) Fe3+ Fe(OH)3 → Fe2O3
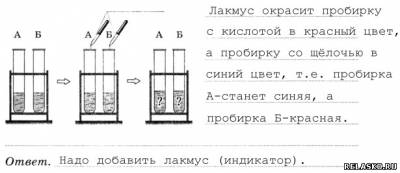
3. В пробирках А и Б находятся известковая вода и раствор гидроксида натрия. Какие качественные реакции необходимо провести, чтобы определить содержимое каждой из пробирок?
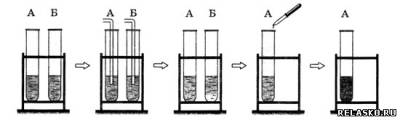
1) Пропускаем сначала углекислый газ, пробирка с щёлочью мутнеет.
2) В другую пробирку капаем раствор лакмуса, она синеет.
Ответ. Углекислый газ и лакмус.
4. Определите заряды ионов металлов и степени окисления элементов в основаниях.
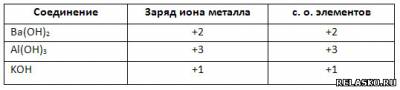
5. Запишите в таблицу «Области применения некоторых оснований» формулы веществ.
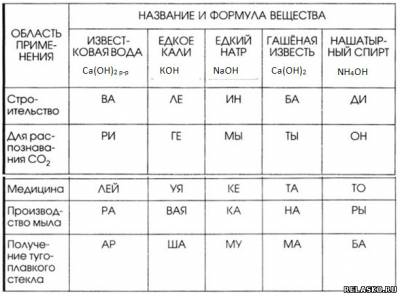
Установите соответствие между веществом и областями его применения. Из слогов, соответствующих правильным ответам, вы составите название насыщенного водного раствора гидроксида бария (II): баритовая вода.
6. Вычислите количество вещества, которое составляют 196 г гидроксида калия. Сколько ионов каждого вида будет содержать эта порция щёлочи?

7. Рассчитайте массу 2,5 кмоль гидроксида бария. Сколько ионов каждого вида будет содержать эта порция щёлочи?

|
| |
| |
| Alicerok | Дата: Среда, 07.10.2015, 09:23 | Сообщение # 40 |
|
Майор
Группа: Проверенные
Сообщений: 88
Награды: 0
Репутация: 0
Статус: Offline
| Тема 20. Кислоты.
Часть I
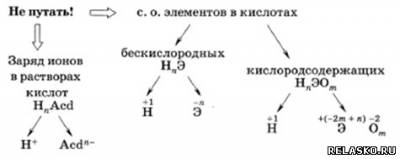
1. Признаки кислот:
- сложные вещества;
- состоят из атомов водорода и кислотного остатков;
- в растворе образуют простые ионы H+ и сложные или простые ионы кислотного остатка - Acd.
Общая формула кислот:
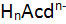 , где n — заряд кислотного остатка. , где n — заряд кислотного остатка.
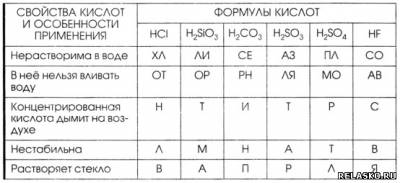
2. Классификация кислот.
1) По числу атомов водорода
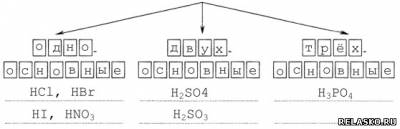
2) По наличию кислорода в кислотном остатке
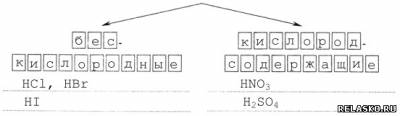
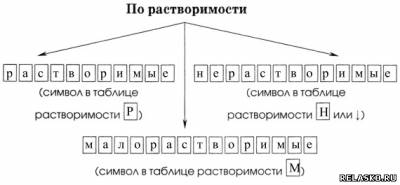
3) По растворимости
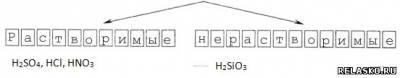
4) По стабильности
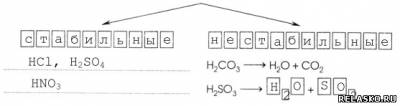
3. Способ образования названий кислот.
1) Бескислородных.

НСl — хлороводородная кислота, H2S — сероводородная кислота.
2) Кислородсодержащих.
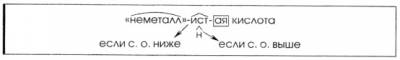
HNO2 — азотистая кислота, HNO3 – азотная кислота.
4. 
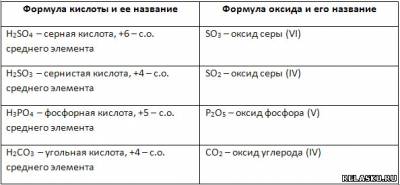
5. Каждой кислоте соответствует свой оксид. Дополните таблицу «Кислоты и соответствующие им оксиды».
6. Кислоты изменяют окраску индикаторов. Дополните таблицу «Изменение окраски индикатора в кислой среде».

|
| |
| |
| Alicerok | Дата: Среда, 07.10.2015, 09:26 | Сообщение # 41 |
|
Майор
Группа: Проверенные
Сообщений: 88
Награды: 0
Репутация: 0
Статус: Offline
| Часть II
1. Поиграйте в «крестики-нолики». Покажите выигрышный путь, который составляют формулы одноосновных кислот.
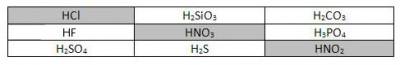
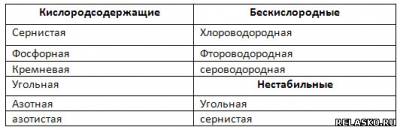
Распределите все приведённые выше кислоты по группам. Запишите их названия.
2. Дайте характеристику фосфорной кислоты H3PO4 по всем признакам классификации.
1) Кислородсодержащая
2) Трёхосновная
3) Средней силы
4) Стабильная.
3. Напишите формулы кислот и соответствующих им оксидов, образованных неметаллами в следующих степенях окисления:

4. Определите заряды ионов, степени окисления элементов в кислотах.

5. Установите соответствие между опасной ситуацией и необходимыми действиями по оказанию первой помощи во избежание химического ожога.

6. В пробирках А и Б находятся растворы гидроксида калия и соляной кислоты. Какие качественные реакции необходимо провести, чтобы определить содержимое каждой из пробирок?
7. Установите соответствие между свойством или применением кислоты и её формулой. Из букв, соответствующих правильным ответам, вы составите название кислоты, которая широко распространена в природе и легко удаляет с тканей пятна ржавчины: лимонная.
8. Вычислите количество вещества, которое составляют 392 кг фосфорной кислоты. Сколько атомов водорода будет содержаться в этой порции кислоты?

|
| |
| |
| Alicerok | Дата: Среда, 07.10.2015, 09:44 | Сообщение # 42 |
|
Майор
Группа: Проверенные
Сообщений: 88
Награды: 0
Репутация: 0
Статус: Offline
| Тема 21. Соли.
Часть I
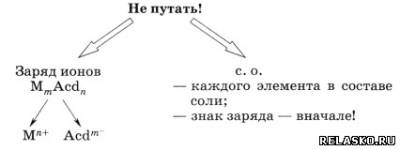
1. Признаки солей:
- сложные вещества;
- состоят из положительных ионов металла и отрицательных ионов кислотного остатка.
2. Способ образования названий солей.

3. Дополните таблицу «Кислоты».
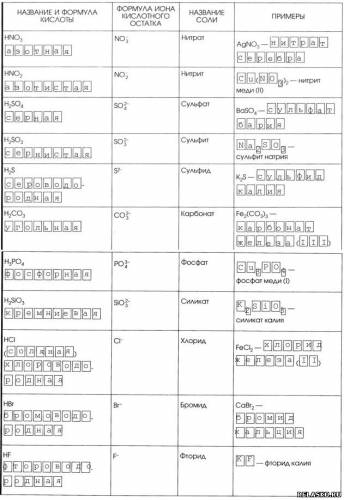
4. 
5. 
6. Каждой соли кислородсодержащей кислоты соответствуют основание и кислота, а также оксиды металла и неметалла:
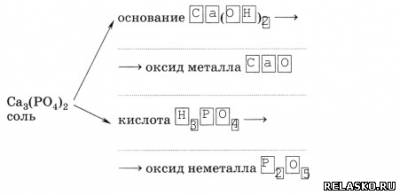
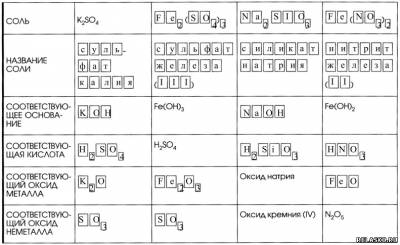
7. Дополните таблицу «Соли и соответствующие им гидроксиды и оксиды».
|
| |
| |
| Alicerok | Дата: Среда, 07.10.2015, 09:49 | Сообщение # 43 |
|
Майор
Группа: Проверенные
Сообщений: 88
Награды: 0
Репутация: 0
Статус: Offline
| Часть II
1. Поиграйте в «крестики - нолики». Покажите выигрышный путь, который составляют формулы солей.
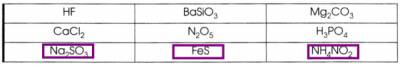
Разделите все приведённые выше соли на растворимые и нерастворимые. Напишите их названия.

2. Составьте формулы солей по названиям.
1) Фосфаты натрия, кальция, алюминия: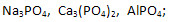
3) Сульфиты калия, бария, цинка:
2) Нитраты меди (II), железа (III), серебра: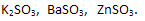
3. Расставьте заряды ионов в следующих соединениях и степени окисления химических элементов.

4. Установите соответствие между формулой соли и её названием.

5. Установите соответствие между формулой соли и её применением или свойством. Из букв, указывающих правильный ответ, вы составите название одного из самых древних связующих материалов на основе сульфата кальция: гипс.
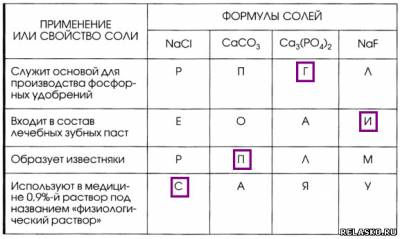
6. Запишите формулы солей и соответствующих им гидроксидов (кислот и оснований), оксидов и простых веществ.

Для каждого варианта составьте формулы бинарных соединений, которые могут быть образованы простыми веществами. Напишите их названия.

7. Вычислите количество вещества, которое составляют 222 кг хлорида кальция. Сколько ионов каждого вида будет содержать это количество? Какова массовая доля хлора в соли?
8. Придумайте условие задачи по теме «Соли». Запишите решение.
Дана соль CuCl2 массой 270 г, найти количество вещества этой соли.
|
| |
| |
| Alicerok | Дата: Среда, 07.10.2015, 09:54 | Сообщение # 44 |
|
Майор
Группа: Проверенные
Сообщений: 88
Награды: 0
Репутация: 0
Статус: Offline
| Тема 22. Кристаллические решётки.
Часть I
1. 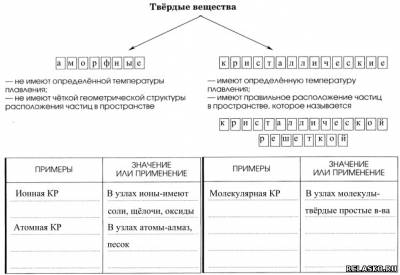
2. Заполните таблицу «Виды химических связей и типы кристаллических решёток».
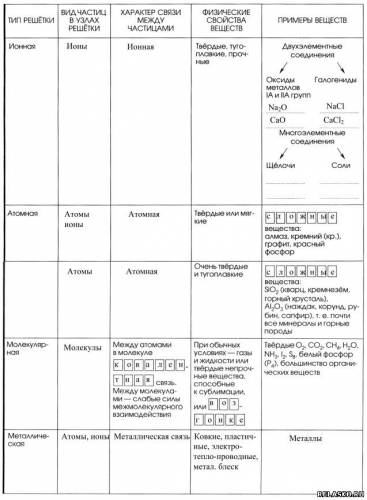
Часть II
1 . Поиграйте в «крестики - нолики». Покажите выигрышный путь, который составляют простые вещества с атомной кристаллической решёткой.
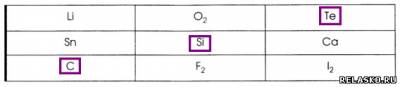
Распределите данные простые вещества по соответствующим столбцам.

2. Запишите формулу вещества, которое является «лишним» в следующем ряду:
оксид кремния (IV), оксид алюминия, алюминий, графит.
Ответ: Al2O3 - оксид алюминия.
3. Верны ли следующие суждения?
А. Мокрое бельё высыхает на морозе потому, что вещества молекулярного строения способны к сублимации (возгонке).
Б. Мокрое бельё высыхает на морозе потому, что молекулы воды имеют низкую Mr.
4) Оба суждения верны.
4. Верны ли следующие суждения?
А. При обычных условиях хлор – газ, бром – жидкость, йод – твёрдое вещество с металлическим блеском, потому что у них разные кристаллические решётки: у хлора – атомная, у брома – молекулярная, у иода – металлическая.
Б. При обычных условиях хлор – газ, бром – жидкость, йод – твёрдое вещество с металлическим блеском, потому что у них одинаковое молекулярное строение, но разная плотность.
3) верно только Б.
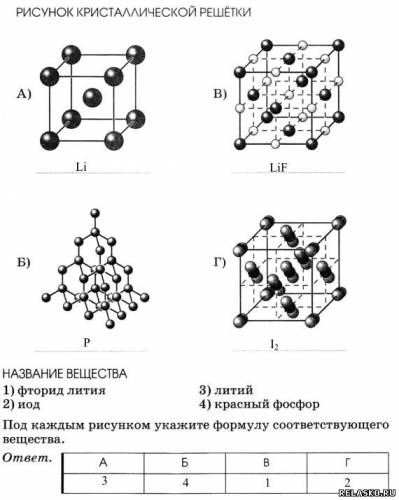
5. Установите соответствие между рисунком кристаллической решётки и названием вещества.
6. С помощью Интернета и других источников информации сделайте презентацию о жизни и научных достижениях Ж. Л. Пруста по следующему плану:
1) детство;
2) учёба в юношеские годы;
3) научная деятельность, основные научные достижения.
1) Пруст родился в г. Анже в семье аптекаря, с самого детства он видел, как его отец готовил лекарства, его это очень интересовало.
2) Учился в парижском университете, организовал лабораторию и собрал ценную коллекцию минералов и реактивов.
3) Занимался исследованием состава различных металлов и их оксидов. Доказал, что многие соединения представляют собой не оксиды, а гидроксиды, первым предложил термин «гидрат», выделил из виноградного сока глюкозу. Открыл закон постоянства химических соединений – это самое выдающееся его достижение.
7. К веществам молекулярного строения не относится:
4) карбонат кальция.
8. Молекулярное строение имеет каждое из веществ, формулы которых приведены в ряду:
4) SO4, I2, HCL
|
| |
| |
| Alicerok | Дата: Среда, 07.10.2015, 10:00 | Сообщение # 45 |
|
Майор
Группа: Проверенные
Сообщений: 88
Награды: 0
Репутация: 0
Статус: Offline
| Тема 23. Чистые вещества и смеси.
Часть I
1. Чистые вещества представлены одним веществом, имеющим одну химическую формулу.
Смеси состоят из нескольких веществ, каждое из которых имеет свою химическую формулу → если свойства компонентов смеси разные, то их можно разделить на основании этих свойств.
2. Классификация смесей (примеры).
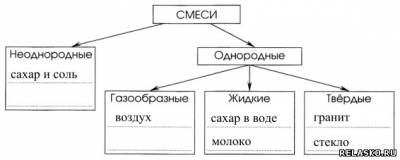
3. Синонимы:
однородные смеси – гомогенные;
неоднородные смеси – гетерогенные.
4. Химический анализ – это установление состава смесей.
Смотреть решебник далее...
|
| |
| |