|
ГДЗ по Химии. 9 класс. Габриелян. Рабочая тетрадь
|
|
| Родион | Дата: Вторник, 29.09.2015, 16:50 | Сообщение # 1 |
|
Подполковник
Группа: Проверенные
Сообщений: 125
Награды: 0
Репутация: 0
Статус: Offline
| Решебник и ГДЗ по Химии. 9 класс. О. С. Габриелян, С. А. Сладков. Рабочая тетрадь

Авторы: О. С. Габриелян, С. А. Сладков
Учебник с задачами, примерами и ответами по ФГОС 2007, 2008, 2009, 2010, 2011, 2012, 2013, 2014 год
Данный решебник и готовые домашние задания по Химии предназначены для учителей и учеников 9 класса средней школы для проверки своих знаний предмета, а также для помощи в решении домашних заданий.
Преподаватели урока Химии с помощью данного учебника смогут легко и быстро проверять ответы на домашние работы у своих учеников, а так же подготовиться к уроку.
Родители учеников могут так же проверять своих детей, на сколько правильно они сделали домашнюю работу.
Оглавление решебника и ГДЗ по Химии. 9 класс. О. С. Габриелян, С. А. Сладков. Рабочая тетрадь
Тема 1. Обобщение сведений о строении вещества и химической реакции. Характеристика химического элемента-металла на основании его положения в периодической системе Д. И. Менделеева.
Тема 2. Характеристика элемента-неметалла на основании его положения в периодической системе Д. И. Менделеева.
Тема 3. Амфотерные оксиды и гидроксиды.
Тема 4. Периодический закон и периодическая система химических элементов Д. И. Менделеева в свете учения о строении атома.
Тема 5. Обобщение сведений о химической реакции.
Тема 6. Скорость химической реакции.
Тема 7. Катализ и катализаторы.
Тема 8. Металлы. Положение металлов в Периодической системе Д. И. Менделеева. Строение атомов и кристаллов. Физические свойства.
Тема 9. Общие химические свойства металлов.
Тема 10. Получение металлов.
Тема 11. Коррозия металлов.
Тема 12. Щелочные металлы.
Тема 13. Соединения щелочных металлов.
Тема 14. Бериллий, магний и щёлочноземельные металлы.
Тема 15. Соединения щёлочноземельных металлов.
Тема 16. Алюминий.
Тема 17. Соединения алюминия.
Тема 18. Железо.
Тема 19. Соединения железа.
Тема 20. Общая характеристика неметаллов.
Тема 21. Водород.
Тема 22. Галогены.
Тема 23. Соединения галогенов.
Тема 24. Кислород.
Тема 25. Сера.
Тема 26. Бинарные соединения серы.
Тема 27. Серная кислота.
Тема 28. Соли серной кислоты.
Тема 29. Азот.
Тема 30. Аммиак.
Тема 31. Соли аммония.
Тема 32. Оксиды азота.
Тема 33. Соли азотной кислоты.
Тема 34. Фосфор.
Тема 35. Соединения фосфора.
Тема 36. Углерод.
Тема 37. Оксиды углерода.
Тема 38. Угольная кислота и её соли.
Тема 39. Кремний.
Тема 40. Силикатная промышленность.
Итоговая контрольная работа.
Готовимся к ГИА.
Сообщение отредактировал Родион - Вторник, 29.09.2015, 16:54 |
| |
| |
| Родион | Дата: Вторник, 29.09.2015, 16:52 | Сообщение # 2 |
|
Подполковник
Группа: Проверенные
Сообщений: 125
Награды: 0
Репутация: 0
Статус: Offline
| Тема 1. Обобщение сведений о строении вещества и химической реакции. Характеристика химического элемента-металла на основании его положения в периодической системе Д. И. Менделеева.
Часть I
1. Заполните таблицу «Характеристика элемента на основании его положения в Периодической системе (ПС) Д. И. Менделеева» на примере элемента кальция.
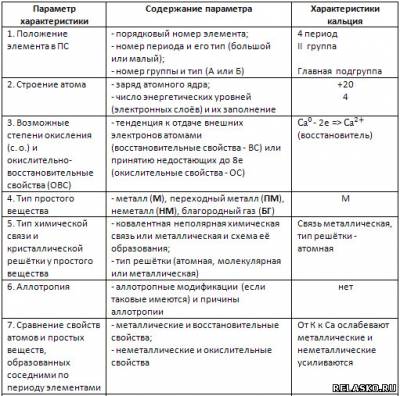
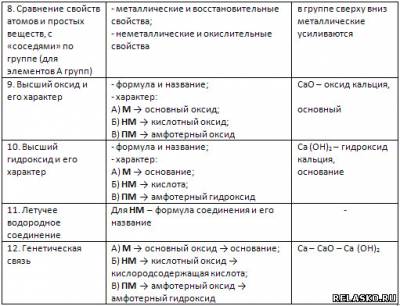
2. Подтвердите характер оксида кальция соответствующими уравнениями реакций, в том числе и ионными, для реакций с участием электролитов:

3. Подтвердите характер гидроксида кальция соответствующими уравнениями реакций в молекулярной, полной и сокращённой ионной формах:

Сообщение отредактировал Родион - Вторник, 29.09.2015, 16:52 |
| |
| |
| Родион | Дата: Вторник, 29.09.2015, 16:54 | Сообщение # 3 |
|
Подполковник
Группа: Проверенные
Сообщений: 125
Награды: 0
Репутация: 0
Статус: Offline
| Часть II
1. Вычеркните «лишнее».
4) Si
2. Какая из следующих групп элементов содержит только металлы?
Нет правильного варианта ответа.
3. Какая из характеристик металлической связи является неточной?
Металлическая связь:
1) характеризуется ненаправленностью;
2) характеризуется ненасыщенностью.
4. Какое физическое свойство не является общим для всех металлов?
3) твёрдое агрегатное состояние при стандартных условиях.
5. Дайте характеристику элемента лития согласно приведённому в части I плану.
1) Это элемент I A группы, 2-го малого периода.
2) +3Li 2е, 1е.
3) Li – сильный восстановитель, который получает с. о. +1.
4-5) Li – это металл, поэтому имеет металлическую кристаллическую решётку, образованную за счёт металлической химической связи, схема которой:

6) аллотропия для лития нехарактерна.
7) Металлические свойства у лития выражены больше, чем у бериллия.
8) Металлические свойства у лития выражены больше, чем у водорода, но меньше, чем у натрия.
9) Оксид лития т6 имеет основный характер и взаимодействует:
с кислотными оксидами;
с кислотами;
с водой.
10) Гидроксид лития LiOH имеет основный характер и является растворимым основанием – щёлочью. Взаимодействует (напишите уравнения возможных реакций в молекулярной, полной и сокращённой ионной формах):

6. Металлы (М) IА группы, или щелочные металлы, образуют водородные соединения с общей формулой МН. В этих соединениях, в отличие от летучих водородных соединений неметаллов, связь ионная и кристаллическая решётка ионная.
Эти бинарные соединения проявляют следующие физические свойства:
Белые кристаллические вещества, похожие на соль.
7. Металлы IIA группы (начиная с Са) – щелочноземельные металлы – образуют водородные соединения с общей формулой т8. Они называются гидридами, имеют ионную кристаллическую решётку, построенную за счёт ионной химической связи, и обладают следующими физическими свойствами: белые солеподобные кристаллические вещества.
При взаимодействии с водой наблюдается реакция обмена:
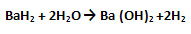
|
| |
| |
| Родион | Дата: Среда, 30.09.2015, 16:18 | Сообщение # 4 |
|
Подполковник
Группа: Проверенные
Сообщений: 125
Награды: 0
Репутация: 0
Статус: Offline
| Тема 2. Характеристика элемента-неметалла на основании его положения в периодической системе Д. И. Менделеева.
Часть I
По плану, рассмотренному на прошлом уроке, дайте характеристику элемента фосфора.
1) Это элемент VA группы ПС, 3-го малого периода.
2) Электронная формула атома: +15Р 2е, 6е, 5е.
3) Фосфор может проявлять окислительные свойства по отношению к металлам и водороду, а также восстановительные свойства по отношению к более электроотрицательным элементам, например: О, Cl.
4-6) Для фосфора характерно явление аллотропии. Он образует две аллотропные модификации: Р красный и Р белый. У первого – атомная кристаллическая решётка, а у второго – молекулярная кристаллическая решётка и формула Р4.
Следовательно, причиной аллотропии фосфора является кристаллическая решётка, т.е. разное строение.
Фосфор красный и молекулы Р4 образованы за счёт ковалентной неполярной связи. Между молекулами Р4 – слабые межмолекулярные силы взаимодействия.
7-8) Р > активный НМ, чем Si, но < активный, чем S.
Фосфор < активный восстановитель, чем Si, но > активный, чем S.
9) Высший оксид фосфора имеет формулу Р2О5 и название оксид фосфора V. Это кислотный оксид.
Он взаимодействует (запишите уравнения возможных реакций, в том числе в полной и сокращённой ионной форме для реакций с участием электролитов):
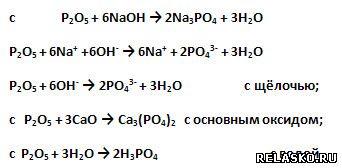
10) Высший гидроксид фосфора – это фосфорная кислота, формула которой .
Это двухосновная, кислородсодержащая, растворимая в воде, нелетучая, стабильная, но слабая кислота. Поэтому в ионных уравнениях реакций с участием фосфорной кислоты её формулу следует записывать в молекулярной форме.
Реакция с металлами для фосфорной кислоты нехарактерна. Остальные свойства – типичные для кислот. Она взаимодействует (составьте уравнения возможных реакций – молекулярные, полные и сокращённые ионные):

11) Летучее водородное соединение фосфора имеет формулу PH3. Оно построено за счёт ковалентной химической связи. Схема её образования:
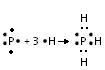
Сообщение отредактировал Родион - Среда, 30.09.2015, 16:20 |
| |
| |
| Родион | Дата: Четверг, 01.10.2015, 10:07 | Сообщение # 5 |
|
Подполковник
Группа: Проверенные
Сообщений: 125
Награды: 0
Репутация: 0
Статус: Offline
| Часть II
1. Вычеркните «лишнее».
4) Be
2. Какая из следующих групп содержит только неметаллы?
1) VIIA
3. Исключите «лишний» элемент с точки зрения возможности образования аллотропных модификаций.
2) азот
4. Какой тип химической связи может иметь место только между атомами неметаллов?
1) ковалентная полярная
4) ковалентная неполярная
5. Раствор летучего водородного соединения хлора в воде называется соляной или хлороводородной кислотой.
Приведите характеристики кислоты:
по основности – одноосновная
по содержанию кислорода – бескислородная
по растворимости – растворимая
по силе – сильная.
Соединение проявляет все типичные свойства кислот (запишите уравнения возможных реакций в молекулярной, полный и сокращённой ионной формах):


7. Оксид хлора (VII) проявляет все типичные свойства кислотных оксидов (подтвердите уравнениями соответствующих реакций в молекулярной, полной и сокращённой ионной формах, где это имеет место):
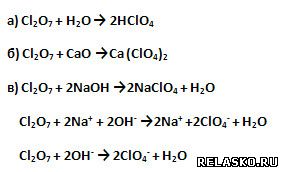
8. Хлорная кислота HClO4 – очень сильная кислота, проявляет все типичные свойства кислот.
Подтвердите этот вывод уравнениями соответствующих реакций в молекулярной, полной и сокращённой ионной формах.
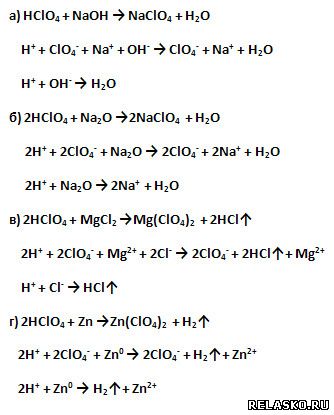
|
| |
| |
| Родион | Дата: Четверг, 01.10.2015, 10:12 | Сообщение # 6 |
|
Подполковник
Группа: Проверенные
Сообщений: 125
Награды: 0
Репутация: 0
Статус: Offline
| Тема 3. Амфотерные оксиды и гидроксиды.
Часть I
1. Амфотерные соединения – это вещества, которые в зависимости от условий реакций проявляют кислотные или основные свойства.
2. Амфотерные гидроксиды – это гидроксиды, например, элементов с порядковыми номерами 4, 13, 30 – Be, Al, Zn. Каждый гидроксид проявляет , в зависимости от условий реакций, свойства то основания, то кислоты.
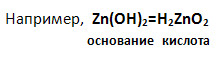
а) Как основание, амфотерный гидроксид взаимодействует с кислотой, образуя соль и воду (запишите молекулярное, полное и сокращённое ионное уравнения реакций).
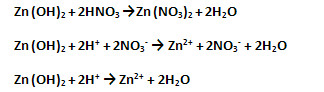
б) Как кислота, амфотерный гидроксид взаимодействует со щёлочью, образуя соль (входит в состав кислотного остатка) и воду (запишите молекулярное, полное и сокращённое ионное уравнения реакций):
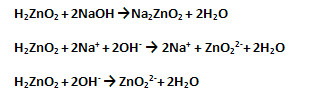
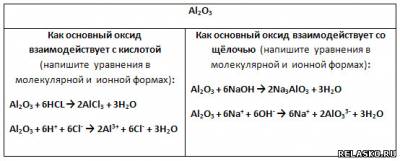
3. Амфотерным гидроксидам соответствуют амфотерные оксиды.
4. Генетический ряд переходного металла:
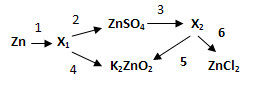
5. Запишите формулы оксида и гидроксида, а также уравнения реакций переходов в молекулярной и ионной формах.

Сообщение отредактировал Родион - Четверг, 01.10.2015, 10:17 |
| |
| |
| Родион | Дата: Четверг, 01.10.2015, 10:22 | Сообщение # 7 |
|
Подполковник
Группа: Проверенные
Сообщений: 125
Награды: 0
Репутация: 0
Статус: Offline
| 1. Дайте характеристику элемента алюминия по плану, с которым вы познакомились на первых уроках:
1) Al – это элемент III А группы малого периода.
2) +13 Al, 2е, 8е, 3е.
3) Это восстановитель, который получают с. о. +3.
4-5) Al – металл, поэтому имеет металлическую кристаллическую решётку, образованную за счёт металлической химической связи, схема которой:
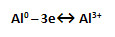
6) аллотропия для алюминия нехарактерна.
7) Как металл, алюминий менее активный, чем магний, но более активный, чем кремний.
8) Как металл, алюминий более активный, чем бор, но менее активный, чем галлий.
9) Оксид алюминия имеет амфотерный характер, поэтому взаимодействует и с кислотой, и с щёлочью, образуя соль и воду.
10) Амфотерный гидроксид является и основанием, и кислотой, которая имеет формулу
взаимодействует (напишите уравнения в молекулярной, полной и сокращённой ионной формах):

2. Оксид хрома (II) CrO проявляет основные свойства, поэтому взаимодействует с кислотными оксидами, кислотами.
Приведите уравнения соответствующих реакций.

3. Оксид хрома (VI) проявляет кислотные свойства, поэтому взаимодействует с основными оксидами, основаниями (щёлочами).
Приведите уравнения соответствующих реакций в молекулярной, полной и сокращённой ионной формах.
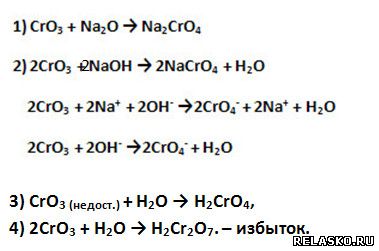
4. Оксид хрома (III) проявляет амфотерные свойства, поэтому взаимодействует и с кислотами, и со щелочами. Приведите уравнения соответствующих реакций в молекулярной, полной и сокращённой ионной формах.
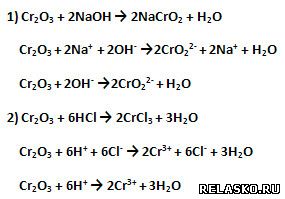
5. Верны ли следующие суждения?
А) Все гидроксиды металлов (I) имеют только основный характер.
Б) Гидроксиды металлов (II) могут быть как основаниями, так и амфотерными гидроксидами.
1) оба суждения верны.
6. Верны ли следующие суждения?
А) Характер гидроксидов переходных металлов VI B и VII B групп зависит от с. о. металлов:
- с низшей с. о. – носит основный характер;
- с промежуточной с. о. – амфотерный характер;
- с высшей с. о. – кислотный характер.
Б. Оксиды и гидроксиды неметаллов всегда имеют кислотный характер.
2) верно только А.
7. Формула высшего оксида марганца а формула его гидроксида – Оба соединения имеют кислотный характер (для подтверждения приведите по два уравнения возможных реакций в молекулярной и ионной формах):

|
| |
| |
| Родион | Дата: Четверг, 01.10.2015, 10:26 | Сообщение # 8 |
|
Подполковник
Группа: Проверенные
Сообщений: 125
Награды: 0
Репутация: 0
Статус: Offline
| Тема 4. Периодический закон и периодическая система химических элементов Д. И. Менделеева в свете учения о строении атома.
Часть I
1. Открытие Д. И. Менделеевым Периодического закона (ПЗ).
Д. И. Менделеев расположил все известные ему 63 элемента в длинный ряд по возрастанию их Ar и выделил в этом ряду отрезки – периоды, в которых свойства элементов и образованных ими простых веществ изменялись одинаково:
1) металлические свойства ослабевают;
2) неметаллические свойства усиливаются;
3) с. о. в высших оксидах – увеличиваются с +1 до +8;
4) с. о. в летучих водородных соединениях – с -4 до -1;
5) оксиды от основных через амфотерные сменялись кислотными;
6) гидроксиды от щелочей через амфотерные сменялись кислотами.
Д. И. Менделеев сделал вывод – сформулировал Периодический закон: Свойства химических элементов и образованных ими веществ находятся в периодической зависимости от относительных атомных масс элементов.
Дата: 7 марта 1869 г.
2. ПЗ и строение атома.
Дальнейшие открытия в науке позволили уточнить формулировку ПЗ.
1) Было открыто сложное строение атома:
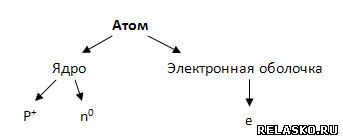
2) Были открыты изотопы – разновидности атомов одного и того же химического элемента с одинаковым числом протонов и разным массовым числом.
Например:
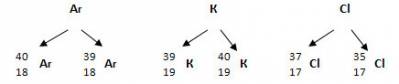
Благодаря этим открытиям современная формулировка ПЗ такова: Свойства химических элементов и образованных ими веществ находятся в периодической зависимости от зарядов их атомных ядер.
3. Периодическая система (ПС) – графическое отображение ПС, поэтому принятая в ней символика соответствует особенностям строения атомов химических элементов.
1) Порядковый номер элемента соответствует заряду ядра, т.е. числу Р+ - протонов в нём. Число других частиц ядра n0 находят по формуле: n0 = A – P+. Число е- в электронной оболочке также соответствует N элемента.
2) Номер периода элемента соответствует числу слоёв или уровней для электронной оболочки атома.
3) Номер А группы соответствует числу электронов на внешнем уровне.
4) Причины изменения свойств элементов объясняются особенностями строения их атомов.
В периодах слева направо - металлические свойства ослабевают, а неметаллические свойства усиливаются, потому что:
а) увеличиваются заряды атомных ядер
б) увеличивается число е на внешнем уровне
в) число энергических уровней постоянно
г) радиус атома уменьшается
5) В А группе сверху вниз металлические свойства усиливаются, а не металлические свойства ослабевают, потому что:
а) увеличиваются заряды атомных ядер
б) число е на внешнем уровне постоянно
в) увеличивается число энергетических уровней
г) увеличивается радиус атома
6) Заряд ядра атомов химических элементов возрастает монотонно, а свойства изменяются периодически, потому что свойства химических элементов находятся в периодической зависимости от зарядов ядер.
Открытие ПЗ и создание ПС позволили:
1) исправить неверные Ar некоторых элементов, например: Ar (Ge)
2) исправить неверные с. о. некоторых элементов, например: Zn, Al.
3) предсказать, описать свойства, указать пути открытия ещё неоткрытых элементов.
Триумф ПЗ для открытия:
-галлий, его химический знак Ga,
-кремний, его химический знак Si,
-алюминий, его химический знак Al.
4) на основании ПЗ и ПС открыты и созданы новые химические элементы, названы в честь России и русских учёных:
- Менделевий, химический знак Md;
− Флеровий, химический знак Fl;
− Рутений, химический знак Ru.
|
| |
| |
| Родион | Дата: Четверг, 01.10.2015, 10:28 | Сообщение # 9 |
|
Подполковник
Группа: Проверенные
Сообщений: 125
Награды: 0
Репутация: 0
Статус: Offline
| Часть II
1. Заряд ядра атома железа равен:
3) +26
2. Число протонов в атоме ванадия равно:
2) 23
3. Число электронных слоёв (энергетических уровней) в электронной оболочке атома соответствует:
3) номеру периода
4. Такую же электронную конфигурацию, как у атома аргона, имеет ион:
3) s-2
5. Восемь электронов на внешнем электронном уровне имеет:
6. Число электронов в ионе железа Fe3+ равно:
3) 23
7. Верны ли следующие суждения?
А. Номер группы соответствует числу валентных электронов на внешнем слое атома для элементов А и В групп.
Б. Номер периода соответствует числу электронных слоёв (энергетических уровней) в электронной оболочке атома.
1) оба суждения верны.
8. Используя стрелки →(усиление) или ←(ослабление), укажите характер изменения свойств элементов и образованных ими веществ в периодах слева направо.
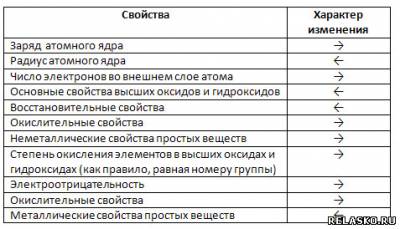
9. Укажите характер изменения свойств элементов А групп (сверху вниз) и образованных ими веществ, используя стрелки ↓ или ↑ (уменьшение или увеличение).
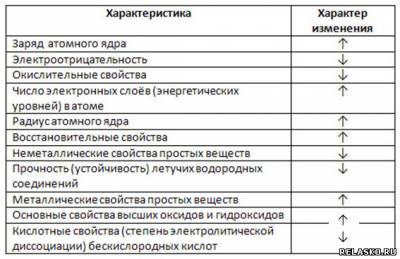
|
| |
| |
| Родион | Дата: Четверг, 01.10.2015, 10:29 | Сообщение # 10 |
|
Подполковник
Группа: Проверенные
Сообщений: 125
Награды: 0
Репутация: 0
Статус: Offline
| Тема 5. Обобщение сведений о химической реакции.
Часть I
1. Химическая реакция, или химическое явление, - это процесс образования новых веществ.
2. Классификация химических реакций:
1) по числу и составу реагирующих и образующихся веществ различают:
реакции:
- соединения;
- разложения;
- обмена;
- замещения.
2) по тепловому эффекту:
- экзотермические;
- эндотермические.
3) по фазе (агрегатному состоянию веществ):
- гомогенные;
- гетерогенные.
4) по направлению:
- обратимые;
- необратимые.
5) по использованию катализатора:
- каталитические (в частности, и с использованием биологических катализаторов ферментов – ферментативные реакции).
6) по изменению с. о.:
- ОВР;
- не окислительно-восстановительные.
3. К ОВР относятся все реакции замещения ите реакции соединения и разложения, в которых участвует простое вещество.
Атомы, ионы или молекулы, принимающие е, называют окислители, а отдающие е – восстановители.
|
| |
| |
| Родион | Дата: Четверг, 01.10.2015, 10:31 | Сообщение # 11 |
|
Подполковник
Группа: Проверенные
Сообщений: 125
Награды: 0
Репутация: 0
Статус: Offline
| Часть II
1.Взаимодействие растворов сульфата калия и нитрата свинца относятся к реакциям:
3) ионного обмена
2. Взаимодействие кислоты и щёлочи относится к реакциям:
2) обмена, нейтрализации
3. К окислительно-восстановительным реакциям относят все реакции:
2) замещения
4. Верны ли следующие суждения?
А. Реакция соединения является окислительно-восстановительной, если реагируют только сложные вещества.
Б. Реакция соединения является окислительно-восстановительной, если реагирует хотя бы одно простое вещество.
3) верно только Б
5. Верны ли следующие суждения?
А. Если условием протекания реакции является нагревание, то эта реакция является эндотермической.
Б. Все реакции разложения, в которых образуются простые вещества, - эндотермические реакции.
1) оба суждения верны
6. Получение оксида серы (VI) из оксида серы (IV) – это реакция:
1) соединения
2) каталитическая
4) окислительно-восстановительная
7. Допишите схему реакции и составьте её уравнение, используя метод электронного баланса:
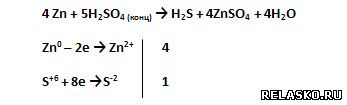
8. Рассчитайте объём водорода, образующегося при взаимодействии 730 г 20%-го раствора соляной кислоты с необходимым количеством цинка. Каково это количество?

|
| |
| |
| Родион | Дата: Четверг, 01.10.2015, 10:34 | Сообщение # 12 |
|
Подполковник
Группа: Проверенные
Сообщений: 125
Награды: 0
Репутация: 0
Статус: Offline
| Тема 6. Скорость химической реакции.
Часть I
1. Скорость химической реакции (Vp)– это изменение концентраций реагирующих веществ в единицу времени.
Формула для нахождения Vp = ΔC/Δt
2. Концентрация – это количество реагентов, участвующих в химической реакции.
3. Химическая кинетика – это раздел химии, в котором изучают скорости и механизмы реакций.
4. Зависимость Vp от природы реагирующих веществ на примере взаимодействия:
кислота + металл = соль + водород.

5. Зависимость Vp от концентрации – при увеличении Vp растёт.
6. Пути повышения Vp:
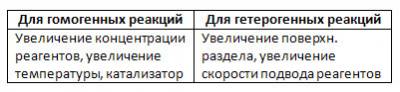
Зависимость Vp от концентрации и от температуры – прямо пропорциональная зависимость – это закон Вант-Гоффа.
Vp зависит от катализатора (см. тему следующего урока).
|
| |
| |
| Родион | Дата: Четверг, 01.10.2015, 10:36 | Сообщение # 13 |
|
Подполковник
Группа: Проверенные
Сообщений: 125
Награды: 0
Репутация: 0
Статус: Offline
| Часть II
1. Единица измерения скорости химической реакции:
1) моль/л•с
2. Скорость любой химической реакции зависит от:
2) температуры
3. С наибольшей скоростью с водородом реагирует:
1) фтор
4. С наименьшей скоростью с водой реагирует:
1) литий
5. Одинаковые по размеру кусочки магния взаимодействуют с наибольшей скоростью с соляной кислотой, если:
2) увеличить концентрацию кислоты
6. Для увеличения скорости химической реакции
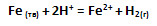
необходимо:
4) увеличить концентрацию кислоты
Создайте изображение, показывающее зависимость Vp от площади соприкосновения реагирующих веществ.

7. Какой график отражает зависимость Vp от t?
Ответ: 3.
|
| |
| |
| Родион | Дата: Четверг, 01.10.2015, 10:44 | Сообщение # 14 |
|
Подполковник
Группа: Проверенные
Сообщений: 125
Награды: 0
Репутация: 0
Статус: Offline
| Тема 7. Катализ и катализаторы.
Часть I
1. Катализаторы – это вещества, изменяющие скорость протекания реакций, но при этом не расходующиеся.
2. Биологические катализаторы белковой природы – это ферменты.
3. Энергия активации – это энергия, необходимая для разрыва связей в молекулах исходных веществ.
4. Ингибиторы – это вещества, замедляющие химические реакции.
5. Катализ – это процесс изменения скорости реакции в присутствии катализаторов.

6. Антиоксиданты – это вещества, участвующие в ОВР, и уменьшающие концентрацию активных окислителей.
Примеры антиоксидантов: α-Токоферол (Витамин Е), β-Каротин (Провитамин А), Ретинол (Витамин А), кислота аскорбиновая (Витамин С)
|
| |
| |
| Родион | Дата: Четверг, 01.10.2015, 10:46 | Сообщение # 15 |
|
Подполковник
Группа: Проверенные
Сообщений: 125
Награды: 0
Репутация: 0
Статус: Offline
| Часть II
1. Применение «кипящего слоя» на производстве способствует увеличению скорости промышленных процессов, потому что:
2) увеличивается поверхность соприкосновения реагирующих веществ
2. Верны ли следующие суждения о катализаторах?
А. Это вещества, которые изменяют скорость химической реакции и расходуются при этом.
Б. Это вещества, которые изменяют скорость и путь протекания химической реакции.
3) верно только Б
3. Верны ли следующие суждения о ферментах?
А. Это биологические катализаторы белковой природы.
Б. Это биологические катализаторы, которые «работают» в узком интервале температур и рН среды, обладают высокой эффективностью и селективностью.
1) оба суждения верны
4. Какой график иллюстрирует «работу» ингибитора?
Ответ: 2.
5. Заполните таблицу.
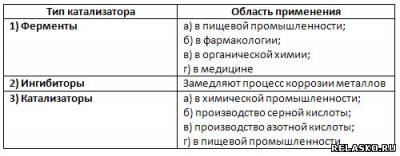
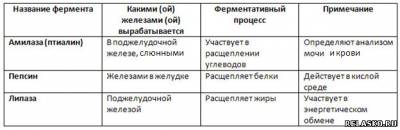
6. Дополните таблицу, используя знания по биологии о пищеварительных ферментах.
7. Предложите способы предотвращения прогоркания сливочного масла.
Защита от кислорода, воздуха – т.к. идёт окисление в присутствии кислорода.
8. Напишите синквейн о катализаторах или ферментах.
1. Катализатор
2. Твёрдый и пористый
3. ускоряет, облегчает, помогает
4. Основа синтеза некоторых веществ
5. Ускоритель
Читать продолжение решебника...
|
| |
| |